
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
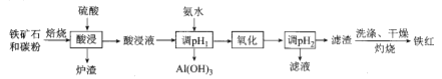
A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
【答案】C
【解析】
高磷鲕状赤铁矿主要含有的![]() ,又称铁红,易溶于强酸,中强酸,外观为红棕色粉末。可用于油漆、油墨、橡胶等工业中,可作为催化剂,炼铁原料。在碳粉与铁矿石焙烧、硫酸酸浸后, 溶液中含有Fe2+、Al3+、Ca2+,而后利用氨水调节溶液pH约5.2-7,可使Al3+沉淀完全,而Fe2+、Ca2+不受影响。利用氧化剂将Fe2+氧化为Fe3+后,由于Fe3+沉降的pH为2.7-3.7,故此时Fe3+因水解成为氢氧化铁而沉降。通过对滤渣洗涤、干燥、灼烧可得氧化铁。
,又称铁红,易溶于强酸,中强酸,外观为红棕色粉末。可用于油漆、油墨、橡胶等工业中,可作为催化剂,炼铁原料。在碳粉与铁矿石焙烧、硫酸酸浸后, 溶液中含有Fe2+、Al3+、Ca2+,而后利用氨水调节溶液pH约5.2-7,可使Al3+沉淀完全,而Fe2+、Ca2+不受影响。利用氧化剂将Fe2+氧化为Fe3+后,由于Fe3+沉降的pH为2.7-3.7,故此时Fe3+因水解成为氢氧化铁而沉降。通过对滤渣洗涤、干燥、灼烧可得氧化铁。
A. 铁红的主要成分是氧化铁,为红棕色,可用于油漆、油墨、建筑物的着色剂,A项正确;
B. 酸浸液中含有Fe2+,遇![]() 溶液生成蓝色的沉淀
溶液生成蓝色的沉淀![]() , B项正确;
, B项正确;
C. 用玻璃棒不断搅拌会破坏氢氧化铁,使一部分氢氧化铁溶解,降低产率,C项错误;
D. 氧化Fe2+时可选用![]() 、NaClO溶液作为氧化剂,将Fe2+氧化为Fe3+。反应原理分别为:2Fe2+ +H2O2+2H+=2Fe3+ +2H2O ,2Fe2++ ClO -+ 2H+ = 2Fe3+ + Cl- + H2O,D项正确;
、NaClO溶液作为氧化剂,将Fe2+氧化为Fe3+。反应原理分别为:2Fe2+ +H2O2+2H+=2Fe3+ +2H2O ,2Fe2++ ClO -+ 2H+ = 2Fe3+ + Cl- + H2O,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)![]() HbO2(aq) H1<0;
HbO2(aq) H1<0;
反应②:Hb(aq)+CO(g)![]() HbCO(aq) H2<0
HbCO(aq) H2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3
HbCO(aq)+O2(g) H3
(1)H3=_____(用H1、H2表示);反应③自发进行的趋势较大,则H1_____H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
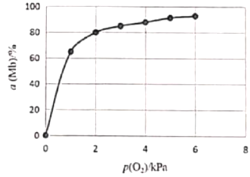
②该反应平衡总数的表达式为![]() ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
③ T℃时,![]() kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O![]() KIO3+3H2↑.下列有关说法正确的是( )
KIO3+3H2↑.下列有关说法正确的是( )
A. 电解时,石墨作阴极,不锈钢作阳极 B. 电解时阳极反应是:I﹣﹣6e﹣+3H2O=IO3﹣+6H+
C. 溶液调节至强酸性,对生产有利 D. 电解后溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是
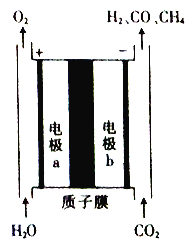
A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
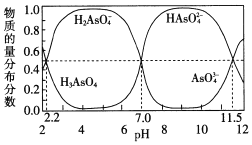
①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)![]() 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g)![]() 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
反应Ⅱ | 反应Ⅲ | ||
活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s)![]() 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
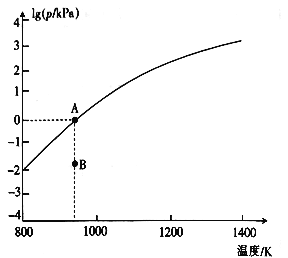
①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13mol·L-1
B. 所得溶液中由水电离产生的c(OH-)=1.0×10-13mol·L-1
C. 所加的烧碱溶液pH=13
D. 所得溶液中的c(Mg2+)=5.6×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。请你参与并完成对有关问题的解答:
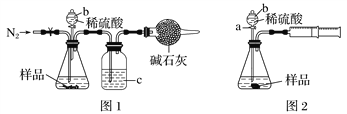
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________________。
(2)乙同学用图2所示装置,取一定质量的样品m g和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的___________________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验:

①操作Ⅰ涉及的实验名称有:__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得样品中Na2CO3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:_______________
II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:
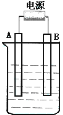
(1)A接的是电源的_______极,B是该装置______。
(2)写出电解时总反应的离子方程式:____________________________ 。
(3)电解后溶液的pH______ ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入_______ 。
(4)若电源为碱性锌锰干电池,负极为______ 正极为______ 电解质溶液是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2) 以KOH溶液为电解质溶液,依据题(1)所选反应设计一个原电池,其负极的电极反应式为_______。
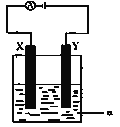
(3) 电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为___________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的c(H+) = _____(假设电解后溶液体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com