
【题目】甲醇是重要的化工原料,在化工生产中有广泛的应用.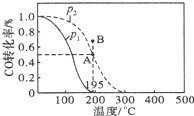
已知反应:CO(g)+2H2(g)CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 测得CO的转化率随温度及压强的变化如下图所示,P2及195℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
(1)0~3min,平均速率V(CH3OH)= , Q0(填“<”“=”或“>”).
(2)图中压强(P1、P2)的大小顺序为 , 理由是 .
(3)在P2及195℃时,该反应的平衡常数K= .
【答案】
(1)0.033mo1?L﹣1?min﹣1;<
(2)P1<P2;相同温度下,增大压强CO转化率提高
(3)25
【解析】解:(1)由表中数据可知,3min内参加反应氢气为8mol﹣4mol=4mol,故v(H2)= ![]() =
= ![]() mol/(L.min),速率之比等于其化学计量数之比,则v(CH3OH)=
mol/(L.min),速率之比等于其化学计量数之比,则v(CH3OH)= ![]() v(H2)=
v(H2)= ![]() ×
× ![]() mol/(Lmin)=0.033mol/(Lmin);由图可知,随温度升高,CO的转化率降低,说明升高温度,平衡向逆反应方向移动,则正反应为放热反应,即Q<0,所以答案是:0.033mol/(Lmin);<;(2)由图可知,相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高,故压强P1<P2 , 所以答案是:P1<P2;相同温度下,增大压强CO转化率提高;(3)在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 开始氢气的浓度为:
mol/(Lmin)=0.033mol/(Lmin);由图可知,随温度升高,CO的转化率降低,说明升高温度,平衡向逆反应方向移动,则正反应为放热反应,即Q<0,所以答案是:0.033mol/(Lmin);<;(2)由图可知,相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高,故压强P1<P2 , 所以答案是:P1<P2;相同温度下,增大压强CO转化率提高;(3)在20L的密闭容器中,按物质的量之比1:2充入CO和H2 , 开始氢气的浓度为: ![]() =0.4mol/L,CO浓度为:
=0.4mol/L,CO浓度为: ![]() =0.2mol/L,由表中数据可知,3min到达平衡,平衡时氢气浓度为:
=0.2mol/L,由表中数据可知,3min到达平衡,平衡时氢气浓度为: ![]() =0.2mol/L,则: CO(g)+2H2(g)CH3OH(g)
=0.2mol/L,则: CO(g)+2H2(g)CH3OH(g)
开始(mol/L):0.2 0.4 0
转化(mol/L):0.1 0.2 0.1
平衡(mol/L):0.1 0.2 0.1
故平衡常数K= ![]() =25,
=25,
所以答案是:25.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)
A.该冶炼锌的反应属于置换反应
B.煤炭中起作用的主要成分是C
C.冶炼Zn的反应方程式为:ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D.倭铅是指金属锌和铅的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)某学生用0.20molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
a.以上步骤有错误的是(填编号)
b.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)
c.下图是某次滴定时的滴定管中的液面,其读数为 mL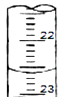
d.根据下列数据:请计算待测盐酸溶液的浓度: mol/L
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
(2)按要求回答下列问题:
a.某温度时,水的离子积常数KW=10﹣13 , 将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b=
b.已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10﹣10 , Ksp(AgY)=1.0×10﹣12 , Ksp(AgZ)=8.7×10﹣17 . 则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y﹣)(填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是( )
A.HgCl2属于离子化合物
B.HgCl2属于共价化合物
C.HgCl2属于非电解质
D.HgCl2是弱酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
A. 该合金中铜与镁的物质的量之比是1∶2
B. 该浓硝酸中HNO3的物质的量浓度是13.0 mol/L
C. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com