
【题目】H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组为探究H2O2的性质做了如下实验:
(1) 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据。

研究小组在设计方案时,考虑了浓度、____、____因素对过氧化氢分解速率的影响。
(2) 另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1 mol·L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小)。________


图1 图2
(3) 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察________,比较得出结论。
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是___。
(4) 已知 FeCl3溶液中主要含有H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是____。
完成表格验证猜想:
所需试剂 | 操作及现象 | 结论 |
_______ | _________ | Cl-对H2O2分解无催化作用 |
【答案】 温度 催化剂  反应产生气泡快慢 消除阴离子不同对实验的干扰 Cl- H2O2,盐酸 向盛有H2O2溶液的试管中加入少量盐酸,然后把带火星的木条伸入试管中,木条不复燃
反应产生气泡快慢 消除阴离子不同对实验的干扰 Cl- H2O2,盐酸 向盛有H2O2溶液的试管中加入少量盐酸,然后把带火星的木条伸入试管中,木条不复燃
【解析】(1)过氧化氢在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响,设计实验方案来验证时,控制变量以确保实验结果的准确性;(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接;(3)①根据反应生成气体的快慢分析;②根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,更为合理;(4)由于双氧水溶液中有水,排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论.
(1)根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关。(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接,装置图为: ;(3)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢来判断;②H2O2催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以消除阴离子不同对实验的干扰,更为合理。(4)由于双氧水溶液中有水,则可排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论:Cl-对H2O2分解无催化作用;所需试剂:双氧水,盐酸,操作及现象:向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃。
;(3)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢来判断;②H2O2催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以消除阴离子不同对实验的干扰,更为合理。(4)由于双氧水溶液中有水,则可排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论:Cl-对H2O2分解无催化作用;所需试剂:双氧水,盐酸,操作及现象:向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物的性质,设计如下实验。请回答下列问题:

(1)装置b的名称______________;按如图所示装置进行实验(夹持装置及尾气处理装置未画出)。实验过程中,装置B中观察到的现象是________________;装置C中有白色沉淀生成,该沉淀是____(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_______________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置(最简单)连接A装置中c处管口,从左到右的顺序为_____________________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是_____________________________。



碱石灰① 品红溶液② 高锰酸钾溶液③ 澄清石灰水④
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是____________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用系统命名法命名有机物 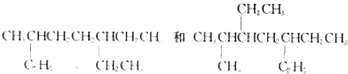 主链碳原子数均为7个
主链碳原子数均为7个
B.某烃的分子式为C10H14 , 它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
C.碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种
D.经测定C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是78%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③Cl- ④CN- ⑤CO
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

b.①N2(g)+O2(g)===2NO(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-565 kJ·mol-1
(1)ΔH1=________。
(2)在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:_________。
Ⅱ. SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101 kPa时:
①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
②H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是______________________。
(2)若反应2H2(g)+O2(g)===2H2O(g)
ΔH=-241.8 kJ·mol-1,根据下表数据求x=_______kJ·mol-1。
化学键 | H—H | O=O | O—H |
断开1 mol化学 键所需的能量/kJ | 436 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:一组同学按下图装置(固定装置已略去)进行实验。

(1) A中反应的化学方程式为__________________。
(2) 实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 __________。
(3) 为说明浓硫酸中的水是否影响B装置现象的判断,还需进行一次实验。实验方案为___________。
实验Ⅱ:另一组同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
i. 将光亮铜丝插入浓硫酸,加热;
ii. 待产生黑色沉淀和气体时,抽出铜丝,停止加热;
iii. 冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
(4) 该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论:________________。
(5) 再次假设,黑色沉淀是铜的硫化物。实验如下:
实验装置 | 现象 |
| 1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有____性。
②能确认黑色沉淀中含有S元素的现象是_______,相应的离子方程式是_____________。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是( ) 
A.可与NaOH和NaHCO3发生反应
B.可以用有机溶剂萃取
C.1mol该有机物可以与5molBr2发生反应
D.该有机物分子中,可能有18个碳原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com