
| A. | NH4Cl中有离子键,是离子化合物 | |
| B. | 46g C2H5OH燃烧放出的热量为乙醇的燃烧热 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
分析 A.含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物;
B.46g乙醇的物质的量是1mol,但该物质是否完全燃烧或其燃烧产物是否是其最稳定氧化物未知;
C. 属于苯酚、
属于苯酚、 属于苯,且二者结构不相似;
属于苯,且二者结构不相似;
D.绿色化学的核心内容之一是“原子经济性”.
解答 解:A.含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,氯化铵中含有离子键,属于离子化合物,故A正确;
B.46g乙醇的物质的量是1mol,但该物质是否完全燃烧或其燃烧产物是否是其最稳定氧化物未知,所以46g C2H5OH燃烧放出的热量不是乙醇的燃烧热,故B错误;
C. 属于苯酚、
属于苯酚、 属于苯,且二者结构不相似,在分子组成上也不相差一个-CH2原子团,所以不是同系物,故C错误;
属于苯,且二者结构不相似,在分子组成上也不相差一个-CH2原子团,所以不是同系物,故C错误;
D.绿色化学的核心内容之一是“原子经济性”,即充分利用反应物中的各个原子,因而既能充分利用资源,又能防止污染,故D错误.
故选A.
点评 本题考查基本概念及绿色化学,为高频考点,明确离子化合物与化学键的关系、燃烧热及同系物概念是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | C8H10含苯环的烃的同分异构体有3种 | |
| C. | 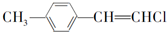 分子中的所有原子不可能共平面 分子中的所有原子不可能共平面 | |
| D. | 莽草酸(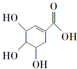 )能与溴水发生取代反应而褪色 )能与溴水发生取代反应而褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80gCuO和Cu2S的混合物含有的Cu原子数一定是NA | |
| B. | 标准状况下,5.6L O2作为氧化剂时转移的电子数一定为NA | |
| C. | 常温常压下,14g C2H4和C3H6混合气体中含有的原子数为3NA | |
| D. | 25℃,1LpH=13的NaOH溶液中含有OH-的数目为 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氨水、水玻璃、漂白粉属于电解质 | |
| B. | Cl2、SO2均使品红溶液褪色,但原理不相同 | |
| C. | 同温同压下,相同体积的任何气体都含有相同的原子数 | |
| D. | Na2O2、FeO是碱性氧化物;NO2、SO3是酸性氧化物;Al2O3、SiO2是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com