
| A | |||||||
| B | C | D |
分析 A、B、C、D、E五种元素都是元素周期表中前四周期元素,原子序数依次增大,E的价电子排布式为3d104s1,则E为Cu;由A、B、C、D四种短周期元素在元素周期表中的相对位置,可知A为F元素、B为Na、C为Al、D为Cl.
(1)C为Al,原子核外电子排布式为1s22s22p63s23p1,失去3s、3p能级电子形成铝离子;
(2)计算ClF2+离子的中Cl原子孤电子对数、价层电子对数,进而确定杂化轨道与空间构型;
(3)HF分子之间存在氢键,沸点最高,其它氢化物分子间为范德华力,相对分子质量越大,范德华力越强,沸点越高;
同周期随原子序数增大元素第一电离能呈增大趋势;
(4)E为Cu,单质的晶体堆积方式为面心立方密堆积,利用均摊法计算晶胞中Cu原子数目,设Cu原子半径为r,则晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,空间利用率=$\frac{晶胞中原子总体积}{晶胞体积}$×100%;
C与D形成的化合物为AlCl3,属于共价化合物;
(5)利用均摊法计算晶胞中O原子数目,结合化学式E2O计算晶胞中Cu原子数目,再计算晶胞质量,结合m=ρV计算晶胞棱长.
解答 解:A、B、C、D、E五种元素都是元素周期表中前四周期元素,原子序数依次增大,E的价电子排布式为3d104s1,则E为Cu;由A、B、C、D四种短周期元素在元素周期表中的相对位置,可知A为F元素、B为Na、C为Al、D为Cl.
(1)C为Al,原子核外电子排布式为1s22s22p63s23p1,原子中有5种能量不同的电子,失去3s、3p能级电子形成铝离子,铝离子核外电子排布式为:1s22s22p6,
故答案为:5;1s22s22p6;
(2)ClF2+离子的中Cl原子孤电子对数=$\frac{7-1-1×2}{2}$=2、价层电子对数=2+2=4,Cl原子采取sp3杂化轨,离子空间构型为V形,
故答案为:sp3;V形;
(3)HF分子之间存在氢键,沸点最高,其它氢化物分子间为范德华力,相对分子质量越大,范德华力越强,沸点越高,故HCl的沸点最低;
同周期随原子序数增大元素第一电离能呈增大趋势,故第一电离能Na<Al,
故答案为:HCl;<;
(4)E为Cu,单质的晶体堆积方式为面心立方密堆积,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,设Cu原子半径为r,则晶胞中Cu原子总体积为4×$\frac{4}{3}$πr3,晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,晶胞体积为(2$\sqrt{2}$r)3=16$\sqrt{2}$r3,空间利用率=$\frac{4×\frac{4}{3}π{r}^{3}}{16\sqrt{2}{r}^{3}}$×100%=74%,
C与D形成的化合物为AlCl3,属于共价化合物,含有共价键,
故答案为:面心立方密堆积;74%;共价键;
(5)晶胞中O原子数目=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,由化学式Cu2O可知晶胞中Cu原子数目8×2=16,晶胞质量为8×$\frac{144}{{N}_{A}}$g,则:ρ g/cm3×(a cm)3=8×$\frac{144}{{N}_{A}}$g,解得a=$\root{3}{\frac{1152}{ρ•{N}_{A}}}$,
故答案为:16;$\root{3}{\frac{1152}{ρ•{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及元素周期表、核外电子排布、杂化方式与空间构型判断、氢键、晶胞结构与计算,是对学生综合能力的考查,(4)(5)为易错点,需要学生具备一定的空间想象与数学计算能力,难度中等.


科目:高中化学 来源: 题型:解答题
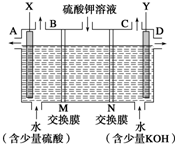 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
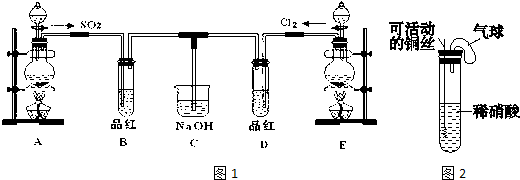
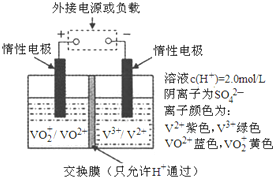 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
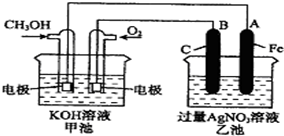 如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )| A. | 甲池是燃料电池,其中通入氧气的一极是原电池的正极 | |
| B. | 乙池是电解池,铁电极是阴极,一段时间后会析出金属银 | |
| C. | 甲池是电解池,乙是原电池 | |
| D. | 甲池一段时间后溶液的pH值会变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 0.01mol/LNaHSO3溶液(mL) | 0.01mol/LKIO3溶液(mL) | H2O(mL) | 反应温度(℃) | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氟酸盛装在细口玻璃瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com