
| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
分析 A、醋酸铵中醋酸根离子和铵根离子均会发生水解;
B、醋酸铵中醋酸根离子和铵根离子均会发生水解,均对水的电离起到促进作用;
C、0.1 mol•L-1的CH3COONH4溶液显中性,说明醋酸根离子水解程度和铵根离子的水解程度相当;
D、根据醋酸铵中铵根离子和醋酸根离子的水解以及物料守恒来回答.
解答 解:A、醋酸铵中醋酸根离子和铵根离子均会发生水解,所以该溶液中:c(CH3COO-)=c(NH4+),小于0.1 mol•L-1,故A错误;
B、醋酸铵中醋酸根离子和铵根离子均会发生水解,均对水的电离起到促进作用,水解程度相等,CH3COO-+H20?CH3C00H+OH-,NH4++H20?NH3•H20+H+,所以c(CH3C00H)=c(NH3•H20)<c(H+)=c(OH- ),故B错误;
C、0.1 mol•L-1的CH3COONH4溶液显中性,说明醋酸根离子水解程度和铵根离子的水解程度相当,c(CH3C00H)=c(NH3•H20),c(H+)=c(OH- ),所以c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+),故C正确;
D、根据醋酸铵中铵根离子和醋酸根离子均会水解,CH3COO-+H20?CH3C00H+OH-,NH4++H20?NH3•H20+H+,根据物料守恒c(CH3COO-)+c(CH3C00H)=0.1mol/L,c(NH3.H20)+c(NH4+)=0.1mol/L,所以c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.1mol•L-1,故D错误.
故选C.
点评 本题涉及溶液中离子浓度之间的关系以及盐的水解规律以及应用等知识,注意知识的归纳和梳理是解题的关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢分子的电子式: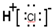 | B. | 硫化氢分子的S2-的结构示意图是: | ||
| C. | O-18原子的符号:818O | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
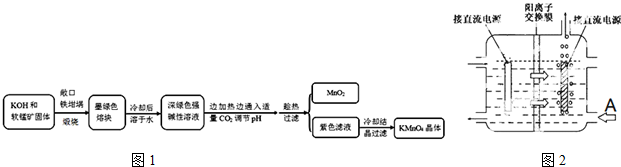
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com