
 ;
; ;
;| 1 |
| 2 |
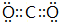 ;
;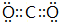 ;直线形;SP;
;直线形;SP;

科目:高中化学 来源: 题型:
| A、元素周期表有7个主族,8个副族 |
| B、元素周期表有3个长周期、4个短周期 |
| C、第ⅢA族位于元素周期表的第三列(从左往右) |
| D、0族位于元素周期表的第18列(从左往右) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①H2SO4溶液: HSO4- H++SO42- | ②NaHSO4溶液: HSO4- H++SO42- | ③盐酸 HCl=H++Cl |
| 10% | 29% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
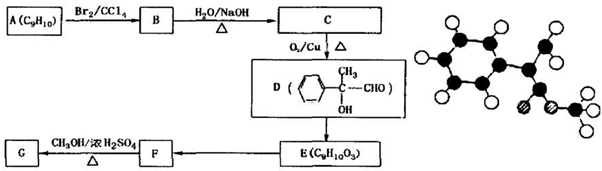
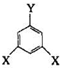 表示(其中X、Y均不为H),且能发生银镜反应的物质有
表示(其中X、Y均不为H),且能发生银镜反应的物质有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
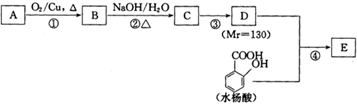
| NaOH/H2O |
| △ |
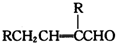
| 反应物1 |
| 反应条件1 |
| 反应物2 |
| 反应条件2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
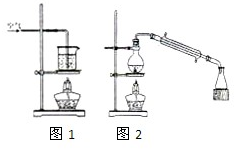 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.查看答案和解析>>
科目:高中化学 来源: 题型:
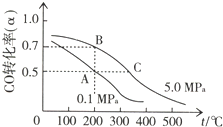
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com