
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是
元素代号 | X | W | Y | Z | Q |
原子半径(×10-12 m) | 37 | 64 | 66 | 70 | 154 |
主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,一定是共价分子
D.Y与W形成的化合物中,Y显负价
B
【解析】
试题分析:根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第VA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是N元素,X原子半径小于W,所以X是H元素。A、Y是O元素、Q是Na元素,二者能形成Na2O、Na2O2,Na2O中只存在离子键,Na2O2中存在离子键和共价键,错误;B、Z与X之间形成的化合物是NH3,氨气中N元素处于最低价态,所以氨气具有还原性,正确;C、由H、O、N三种元素形成的化合物,不一定是共价分子,如硝酸铵为离子化合物,错误;D、OF2中F元素显-1价、O元素显+2价,错误,答案选B。
考点:考查元素的推断,元素周期律的应用


科目:高中化学 来源:2014-2015学年广东省清远市高三上学期期末理综化学试卷(解析版) 题型:填空题
(16分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,CO2的排放量也要大幅减少。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2
③CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3=-867kJ·mol-1
则△H2 = 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s) + H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)
①该反应的化学平衡常数表达式为:K= 。
②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应: CO(g) + H2O(g)  CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应_______________________________________。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是: ___________。
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
如图所示。由下图可以得出的结论是(写两条):_____________________、___________________。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是:
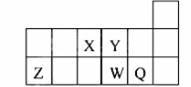
A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:选择题
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
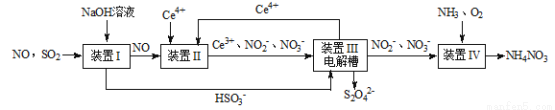
(1)装置Ⅰ中的主要离子方程式为 。
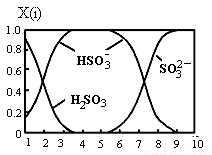 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
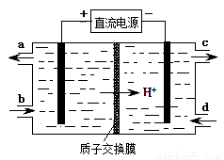
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:[N(CH3)4]2 SO4(s)+ SO2(g) [N(CH3)4]2 S2O6(s)下列说法正确的是
[N(CH3)4]2 S2O6(s)下列说法正确的是
A.[N(CH3)4]+中只含共价键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
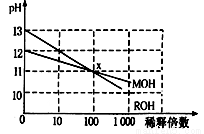
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水 Al3++3OH- ══Al(OH)3↓
B.电解饱和食盐水 2Cl- +2H2O H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C.NaAlO2溶液中通入过量的CO2 2AlO +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2══Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com