
卤族元素是典型的非金属元素,卤素单质及其化合物在工农业生产和生活中都有重要的用途。
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是 。
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是 (填标号)。
A.极性键 B.非极性键 C.离子键 D.σ键
(3)BeCl2的分子空间构型为__________;BF3分子中B-F键的键角为_____________。
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同? 。如果相同,则其杂化方式为 ;如果不相同,则其杂化方式分别为 。(后两个空只能填一个,若两空都填,则不给分)
(5)HF的相对分子质量小于HC1,但其沸点却高于HC1,其原因是________________
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为_________________________;列式计算该晶体的密度(g.cm-3)

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶
B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查
D.滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第三次模拟化学试卷(解析版) 题型:选择题
用惰性电极电解2L0.5mol/L的硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是
A.1 B.2 C.3 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期期中测试化学试卷(解析版) 题型:选择题
将10 mL NO和NO2的混合气体通入装满水倒立在水槽中的量筒内,一段时间后,最后剩余4 mL气体,原混合气体中含NO体积为
A.1 mL B.3 mL C.5 mL D.7 mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中选修化学试卷(解析版) 题型:填空题
甲醇既是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) 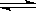 CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g) 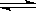 CH3OH(g)+H2O(g) ΔH2=—58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=—58 kJ·mol-1
③CO2(g)+H2(g) 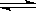 CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 。下图中能正确反映该反应平衡常数K随温度变化关系的曲线为 (填“a”或“b”),其判断理由是 。

(2)合成气的组成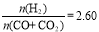 时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
(3)若在一定条件下,容积恒定为VL的反应室中充入amolCO与2amolH2,在催化剂作用下仅发生反应①,下列措施一定使c(CH3OH)/c(CO)增大的是 (填字母)。
A.升高温度 B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2 D.恒温恒容再充入a mol CO和2a mol H2
查看答案和解析>>
科目:高中化学 来源:2016届安徽省三校高三上学期二次模拟化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
气体的体积主要由以下什么因素决定的:①气体分子的直径②气体物质的量的多少③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:填空题
已知热化学方程式H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ/mol,
(1)实验室用0.25 L 0.10mol/L的一元强酸和强碱中和,若中和后溶液体积为0.5 L,中和后的溶液的比热容为4.2×10-3kJ/(g·℃),且密度为1.0g/mL,则溶液温度升高____________℃。
(2)将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
(3)关于用水制取二级能源氢气,以下研究方向不正确的是( )
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在不分解的情况下,使氢气成为二级能源
B.设法将太阳能聚焦产生高温,使水分解产生氢气
C.寻找催化剂使水分解,同时释放能量
D.寻找特殊化学物质用于开发廉价能源,以分解水取得能源
(4)在高温下一氧化碳可将二氧化硫还原为单质硫。
①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com