
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: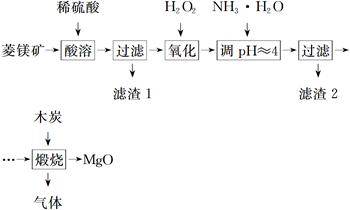
(1)MgCO3与稀硫酸反应的离子方程式为_______________________________________
(2)加入H2O2氧化时,发生反应的化学方程式为____________________________
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C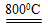 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C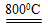 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C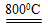 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。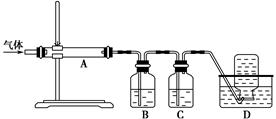
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____________________。
科目:高中化学 来源: 题型:填空题
(1)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,金属性较强的是 (填名称),
可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)通常情况下,微粒X和Y为分子,Z和W为阳离子,E为阴离子,它们都含有10个电子;
Y溶于X后所得的物质可电离出Z和E;X、Y、W三种微粒反应后可得Z和一种白色沉淀。请回答:
①用化学符号表示下列4种微粒:X: Y : Z: E :
②写出两个X、Y、W三种微粒反应的离子方程式: 、
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
从上图推断甲同学想通过测定 计算摩尔盐的纯度。该方案的不足之处在于 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2: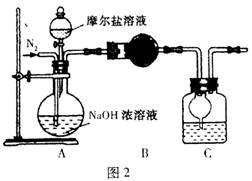
则B与C中的试剂分别是 和 。C中干燥管的作用是 。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为 %(答案精确到小数点后第一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下: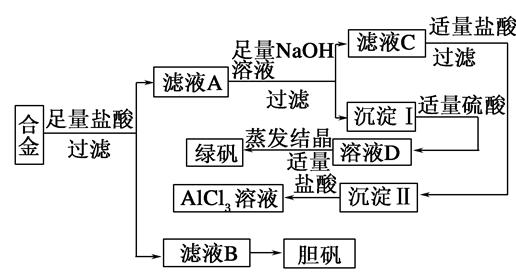
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理” 或“不合理”),理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1请回答下列问题:
(1)甲的化学式是________;乙的电子式是________。
(2)甲与水反应的化学方程式是________。
(3)气体丙与金属镁反应的产物是________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________________。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之______________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间________(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是传统的工业生产金属铝的基本流程图。
请回答:
(1)金属铝常用来制造容器,但铝制餐具不宜用来蒸煮或长时间存放酸性、碱性等食物,写出铝与氢氧化钠溶液反应的离子方程式:_____________________________________。
石油炼制和煤的干馏产品________(填物质名称)作电解铝的阴极和阳极材料。
(2)在冶炼过程中,阳极材料需要定期进行更换,原因是该极材料不断被消耗,产生这种现象的原因是____________________________________(用化学方程式表示)。
(3)工业上通过电解熔融的MgCl2制取金属镁,电解反应方程式为________________。镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物,请说明理由。________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下: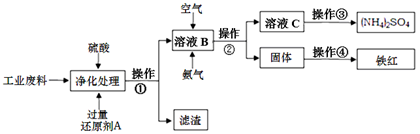
回答下列问题:
(1)滤渣的成分为 ,操作①的名称为 。
(2)上图溶液B中所发生反应的离子方程式为 。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是 。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要 、 。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。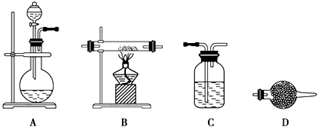
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为____________,其作用是___________________。
②点燃B处酒精灯之前必须进行的操作是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、Y为常见金属单质,且Y是短周期元素,Z既可溶于盐酸,又可溶于氢氧化钠溶液。
据图回答问题: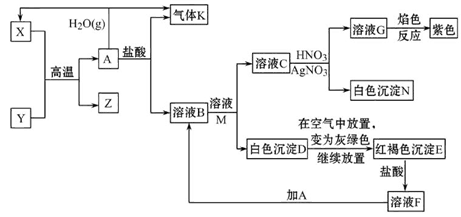
(1)Y在元素周期表中的位置_______________________。
(2)Z与氢氧化钠溶液反应的离子方程式为____________________________。
(3)B与M反应的化学方程式为______________________________________。
(4)A与水蒸气反应的化学方程式为__________________________________。
(5)检验溶液F中阳离子的方法是____________________________________。
(6)在沸水中加入F的饱和溶液的离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com