
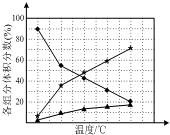
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.分析 (1)①依据热化学方程式和盖斯定律来计算得到;
②依据△H-T△S<0判断反应自发进行;
③次氯酸钠氧化氨气,可以得到N2H4,依据氧化还原反应电子守恒、原子守恒配平写出;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=$\frac{43×0.977}{14}$:$\frac{43×0.023}{1}$=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组计算.
解答 解:(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O,
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3,
故答案为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=$\frac{43×0.977}{14}$:$\frac{43×0.023}{1}$=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3?3N2+H2,故答案为:2HN3?3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
$\frac{5}{6}$x+$\frac{7}{6}$y=15.6
解得:x:y=9:1,
故答案为:9:1.
点评 本题主要考查了电极反应,化学平衡移动、化学计算等,难度中等,培养了学生分析问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液:Al3+、Cu2+、SO42-、Cl- | |
| B. | 使酚酞试液变红的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 在c(H+)=l×l0-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 含有0.lmol.L-1Fe3+的溶液中:H+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中碳碳键是介于C-C和C=C之间的一种特殊共价键 | |
| B. | 甲烷、乙烯都能使酸性KMnO4溶液褪色 | |
| C. | 葡萄糖溶液中加入银氨溶液,水浴加热有银镜生成 | |
| D. | 医用酒精能使蛋白质变性,可用于消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量守恒、电子守恒、电荷守恒 | B. | 电子守恒、质量守恒、电荷守恒 | ||
| C. | 电子守恒、电荷守恒、质量守恒 | D. | 电荷守恒、质量守恒、电子守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
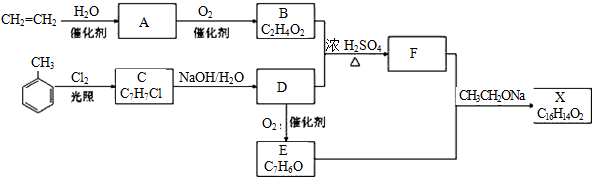
 .
. .
.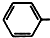 CH2OCH2CH2CHO
CH2OCH2CH2CHO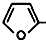 CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3.
COOCH2CH2CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com