
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
分析 (1)根据平衡常数的定义写出反应的平衡常数表达式,根据v=$\frac{△C}{△t}$计算反应速率;
(2)t2min时反应的水为0.9mol-0.3mol=0.4mol,由方程式可知参加反应的CO为0.6mol,故t2min时CO为1.8mol-0.6mol=1.2mol,与t1min时CO的物质的量相等,则t1min时到达平衡状态.若保持其他条件不变,起始时向容器中充入0.90molCO(g)和1.80molH2O(g),与原平衡中物质的量互换,二者按物质的量1:1反应,平衡常数不变,则生成物中同种物质的浓度相等,恒容条件下同种物质的物质的量相等;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
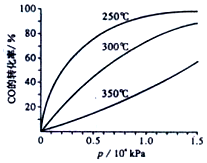
II、从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动;
III、利用将1.0mol CO和1.0mol H2O(g)充入某固定容积的反应器中达到平衡时,发现有$\frac{2}{3}$的CO转化为CO2,根据化学平衡的三段法计算出平衡时的量,根据公式计算出H2O(g)的转化率,然后计算该温度下的平衡常数,再结合Qc与K的关系,判断反应进行的方向,确定V正与V逆的关系.
解答 解:(1)反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$,由表中数据,可知t1min内△n(CO)=1.8mol-1.2mol=0.6mol,由方程式可知△n(H2)=△n(CO)=0.6mol,则v(H2)=$\frac{\frac{0.6mol}{2L}}{{t}_{1}min}$=$\frac{0.3}{{t}_{1}}$mol/(L.min),故答案为:$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;$\frac{0.3}{{t}_{1}}$mol/(L.min);
(2)t2min时反应的水为0.9mol-0.3mol=0.6mol,由方程式可知参加反应的CO为0.6mol,故t2min时CO为1.8mol-0.6mol=1.2mol,与t1min时CO的物质的量相等,则t1min时到达平衡状态,平衡时二氧化碳为0.6mol.若保持其他条件不变,起始时向容器中充入0.90molCO(g)和1.80molH2O(g),与原平衡中物质的量互换,二者按物质的量1:1反应,平衡常数不变,则生成物中同种物质的浓度相等,恒容条件下同种物质的物质的量相等,故到达平衡时n(CO2)=0.60mol,c(CO2)=$\frac{0.60mol}{2L}$=0.30mol/L,故答案为:0.3mol/L;
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变不能说明到达平衡,故a错误;
b.该反应前后气体的体积不变,混合气体的质量不变,气体的密度始终不变,故b错误;
c.可逆反应到达平衡时,各物质的浓度不变,故c(CO)不随时间改变,说明到达平衡,故c正确;
d.单位时间里生成CO和CO2的物质的量相等,说明单位时间内生成的物质的量与消耗CO的物质的量相等,说明到达平衡,故d正确;
故选cd;
II、从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低;
III、假设容器体积为1L,由到平衡时,发现有$\frac{2}{3}$的CO转化为CO2,则
H2O (g)+CO(g)  H2 (g)+CO2(g)
H2 (g)+CO2(g)
开始(mol/L) 1 1 0 0
转化(mol/L) $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
平衡(mol/L) $\frac{1}{3}$ $\frac{1}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
(1)达平衡时H2O(g)的转化率是$\frac{\frac{2}{3}}{1}$×100=66.7%,故答案为:66.7%;
则此反应的平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{1}{3}×\frac{1}{3}}$=4;
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则Qc=$\frac{1×1}{1×0.2}$=5<K,说明此时反应逆向进行,即V正<V逆,故答案为:<.
点评 本题考查化学平衡计算,涉及反应速率计算、平衡常数应用与影响因素,侧重考查学生对数据的分析处理能力,易错点为化学平衡常数的应用,根据Qc与K之间的关系判断反应进行的方向,难度中等.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
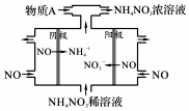 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
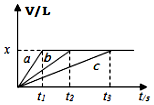 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 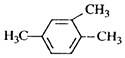 1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 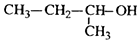 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 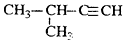 2-甲基-3-丁炔 2-甲基-3-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
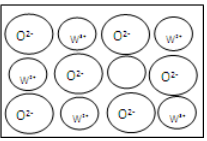 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com