
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | +3价离子3d能级为半充满 |
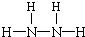 ,NH3分子中N原子与H原子之间形成1对共用电子对,故其电子式为:
,NH3分子中N原子与H原子之间形成1对共用电子对,故其电子式为: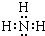 ,
,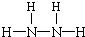 ;
;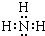 ;
;

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、56g铁发生氧化还原反应,一定失去2NA个电子 |
| B、18gD2O含有的质子数为10NA |
| C、常温常压下,46 gNO2和N2O4的混合物中含有的原子数为3NA |
| D、1mol/L Na2CO3溶液中含有的Na+数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液和稀硫酸反应:H++OH-=H2O |
| B、氯化铝溶液加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| C、碳酸钡溶于盐酸:BaCO3+2H+=Ba2++H2O+CO2↑ |
| D、氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E均为中学化学常见的物质,它们间的反应关系如下图所示.
A、B、C、D、E均为中学化学常见的物质,它们间的反应关系如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸与碳酸钡反应:CO32-+2H+═CO2↑+H2O |
| B、往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
| C、稀硫酸溶液与氨水反应:H++OH-═H2O |
| D、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com