
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
分析 (1)根据反应方程式N2+3H2?2NH3,根据体积的变化求反应的氮气的体积,然后根据转化率为=$\frac{变化量}{起始量}×100%$;
(2)n=$\frac{V}{{V}_{m}}$和m=nM,结合氨水质量分数为$\frac{氨的质量}{氨水的总质量}×100%$;
(3)由反应4NH3+5O2?4NO+6H2O(g),设氧气的体积为1.7,所以空气体积为:8.5,氨气体积为1,氨的转化率可达95%,所以反应的氨气体积为0.95,由反应方程式可知生成一氧化氮的体积为0.95,增加的体积为:$\frac{0.95}{4}$=0.238,所以反应后NO的体积分数为:$\frac{0.95}{8.5+1+0.238}×100%$=9.8%;
(4)根据转移电子确定合金中的其它元素,再根据转移电子相等计算银的质量,从而确定银的质量分数,解银和铜的质量分数确定锌的质量分数.
解答 解:(1)根据反应方程式N2+3H2?2NH3△V,
1 2
V变 100-90
所以V变=$\frac{100-90}{2}$=5L,
所以转化率为=$\frac{变化量}{起始量}×100%$=$\frac{5L}{100L×\frac{1}{4}}$=20%,
故答案为:20%;
(2)n=$\frac{V}{{V}_{m}}$=$\frac{500L}{22.4L/mol}$=22.32mol,所以m=nM=22.32mol×17g/mol=379.46g,所以氨水质量分数为:$\frac{379.46g}{379.46g+1000g}×100%$=27.5%,故答案为:27.5%;
(3)由反应4NH3+5O2?4NO+6H2O(g),设氧气的体积为1.7,所以空气体积为:8.5,氨气体积为1,氨的转化率可达95%,所以反应的氨气体积为0.95,由反应方程式可知生成一氧化氮的体积为0.95,增加的体积为:$\frac{0.95}{4}$=0.238,所以反应后NO的体积分数为:$\frac{0.95}{8.5+1+0.238}×100%$=9.8%,故答案为:9.8%;
(4)合金中其它金属的质量=2.832g×(1-75%)=0.708g,
假设与硝酸反应的金属全部是银,则银的质量=$\frac{0.0038mol×4}{1}$=1.642g>0.708g,
假设与硝酸反应的金属全部是铜,则铜的质量=$\frac{0.0038mol×2}{1}$=0.486g<0.708g,
则合金中还有Cu和Ag,
设银的质量为m,则铜的质量=0.708-m,根据转移电子守恒得
$\frac{0.708-m}{64g/mol}$×2+$\frac{m}{108}$=0.0038mol×4,
m=0.324g,银的质量分数=$\frac{0.324g}{2.832g}$×100%=11.44%,
则铜的质量分数=25%-11.44%=13.56%,
故答案为:Ag:11.44%;Cu:13.56%.
点评 本题考查了物质的量的有关计算,根据物质之间的关系是解本题关键,注意差量在解题中的运用,注意(4)中合金中其它元素的确定方法,难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
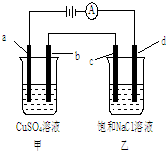
| A. | 甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 | |
| B. | 电解一段时间后,b极质量增加,d极附近滴加酚酞溶液变红 | |
| C. | 甲烧杯中a电极发生氧化反应,电极反应式为:4OH-+4e-═O2↑+2H2O | |
| D. | C是阳极,电子从d电极通过溶液流向c电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH溶液和明矾的水溶液 | B. | Na2CO3溶液和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | 盐酸和NaAlO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
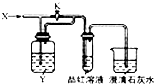 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 5.6g | C. | 2.8g | D. | 0.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | 2Al+2NaOH+6H2O=2NaAlO2+3H2↑ | D. | CaCO3=CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
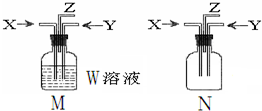 利用如图M、N两个装置进行相关实验,下列有关说法正确的是( )
利用如图M、N两个装置进行相关实验,下列有关说法正确的是( )| 选项 | 所用装置 | 描述 | 结论 |
| A | M | W:BaCl2;X:CO2 Y:SO2 | M中有白色沉淀生成 |
| B | M | W:饱和食盐水;先通入X:CO2,再通入Y:NH3 | M中制得小苏打 |
| C | N | X:NH3 Y:Cl2 | Z出口有白烟产生 |
| D | N | X:NH3Y:O2 | Z出口有红棕色气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com