
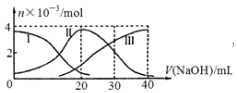
 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
分析 A.根据图知,溶液中存在HA-、H2A、A2-,说明该酸是二元弱酸,在水溶液中部分电离;
B.当V(NaOH)=40mL时,二者恰好完全反应生成强碱弱酸盐Na2A,含有弱离子的盐促进水电离;
C.当V(NaOH)=20mL时,二者恰好完全反应生成NaHA,溶液中存在HA-、H2A、A2-,说明HA- 能电离和水解,且c(H2A)<c(A 2- ),说明其电离程度大于水解程度,导致溶液呈酸性,其电离和水解程度都较小;
D.当V(NaOH)=30mL时,3n(H2A)=2n(NaOH),发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒和物料守恒.
解答 解:A.根据图知,溶液中存在HA-、H2A、A2-,说明该酸是二元弱酸,在水溶液中部分电离,所以其二元酸的电离方程式为H2A?H ++HA -;HA-?H++A2-,故A错误;
B.当V(NaOH)=40mL时,二者恰好完全反应生成强碱弱酸盐Na2A,含有弱离子的盐促进水电离,所以Na2A促进水电离,故B错误;
C.当V(NaOH)=20mL时,二者恰好完全反应生成NaHA,溶液中存在HA-、H2A、A2-,说明HA- 能电离和水解,且c(H2A)<c(A 2- ),说明其电离程度大于水解程度,导致溶液呈酸性,其电离和水解程度都较小,则溶液中离子浓度大小顺序是:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ),故C正确;
D.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA-)+3c(H2A)═c(A2-)+2c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及图象分析能力,明确曲线变化趋势及其原理、溶液中溶质成分及其性质是解本题关键,正确运用溶液中存在的守恒,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CuO | B. | MnO2 | C. | Fe2O3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
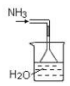 | 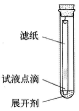 | 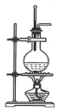 | 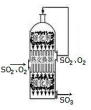 |
| A.吸收多余氨气 | B.Fe3+、Cu2+的分离 | C.酒精和浓硫酸制取乙烯 | D.充分利用反应中的能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
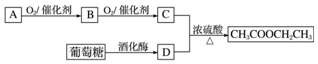
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
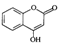 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的分子式为C5H10O2 | |
| B. | X可能的结构有两种 | |
| C. | Y中含有的官能团有羧基和碳碳双键 | |
| D. | X与Y相对分子质量相差14,则X与Y互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与足量盐酸反应 | B. | 碳酸钠与足量盐酸反应 | ||
| C. | 碳酸钠与足量醋酸反应 | D. | 碳酸钡与足量硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
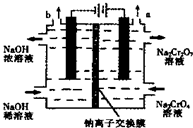 某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )
某工厂采用石墨电极电解Na2CrO4溶液,实现Na2CrO4到 Na2Cr2O7的转化,其装置如图所示.下列说法正确的是( )| A. | 阳极区的pH会不断下降 | |
| B. | 溶液中Na+从阴极移向阳极 | |
| C. | 该电解池的两电极材料只能用石墨不能用铁 | |
| D. | 阳极区发生的反应是:2H2O-4e-═O2↑+4H+,2CrO42-+2H+═Cr2O72-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com