

分析 (1)A装置中甲烷与氧气发生自发的氧化还原反应,是原电池,则B为电解池;
(2)A装置中,酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(3)惰性电极电解NaCl溶液,生成NaOH、氢气、氯气;B池中b为阴极,阴极上生成氢气,a为阳极,阳极上生成氯气,根据电解方程式计算;
(4)根据电极方程式和电子守恒计算.
解答 解:(1)A装置中甲烷与氧气发生自发的氧化还原反应,是原电池,B有外加电源为电解池;故答案为:电解池;
(2)A装置中,酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,其电极方程式为:CH3OH-6e-+H2O=CO2+6H+;
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(3)氯化钠和水在电解条件下生成氢气、氯气和氢氧化钠,所以电池反应式为2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
B池中b为阴极,阴极上生成氢气,a为阳极,阳极上生成氯气,已知n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,则n(NaOH)=0.1mol,所以c(OH-)=$\frac{0.1mol}{1L}$=0.1mol/L,则溶液的pH=13;
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;13;
(4)B池中电解生成氢气的物质的量为0.05mol,则转移电子为0.1mol,A池中正极的电极方程式为O2+4H++4e-═2H2O,转移0.1mol电子时,消耗氧气为0.025mol;
故答案为:0.025.
点评 本题考查原电池和电解池原理,侧重考查学生分析计算能力,明确各个电极上发生的反应是解本题关键,注意结合转移电子守恒进行计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
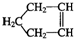 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
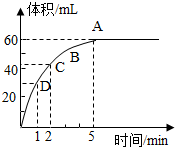
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当正反应与逆反应速率相等时,平衡不移动 | |
| B. | 当正反应大于逆反应速率时,平衡向正反应方向移动 | |
| C. | 当正反应小于逆反应速率时,平衡向正反应方向移动 | |
| D. | 反应速率发生改变,平衡不一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
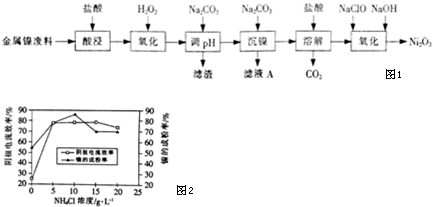
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
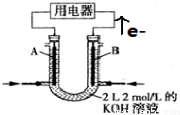 将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 无论反应时间长短,最终生成的SO3一定少于2 mol | |
| B. | 使用催化剂的目的是加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2和SO3的物质的量相等 | |
| D. | 该反应在较高温度下进行,有利于提高SO3的产率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com