
����Ŀ���ú�������������ͭ��ȡ�Ȼ�ͭ���壨CuCl2��xH2O���������²�����
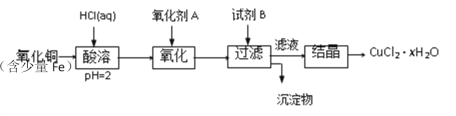
��֪����pHΪ4~5ʱ��Fe3+������ȫˮ���������Cu2+ȴ��ˮ�⡣
(1)�������ܹ����з�����Ӧ�����ӷ���ʽ�У�______
(2)������A��ѡ��_______�����ţ���ͬ��
��Cl2 ��KMnO4 ��HNO3
(3)Ҫ�õ��ϴ��IJ�Ʒ���Լ�B��ѡ��_______
��NaOH ��FeO ��CuO
(4)�Լ�B��������_______
�������Һ��pH �ڽ�����Һ��pH
��ʹFe3+��ȫ���� ��ʹCu2+��ȫ����
(5)����Һ�����ᾧ�õ��Ȼ�ͭ����ķ�����___________����ʵ���Ⱥ�˳�����ţ�
�ٹ��� ������Ũ�� ���������� ����ȴ
(6)Ϊ�˲ⶨ�Ƶõ��Ȼ�ͭ���壨CuCl2��xH2O����xֵ��ij��ȤС�����������ʵ�鷽����
����һ����ȡm g�����������������ټ���Ϊֹ����ȴ������������ˮCuCl2������Ϊn g��
����������ȡm g���塢������������������Һ�����ˡ�����ϴ�Ӻ���С��������������ټ���Ϊֹ����ȴ���������ù��������Ϊn g��
��������������ʵ�鷽����������ȷ�ķ�����______���ݴ˼����x = ______________���ú�m��n�Ĵ���ʽ��ʾ����
���𰸡�Fe + 2H+ �� Fe2+ + H2����CuO + 2H+ �� Cu2+ + H2O �� �� �٢� �ڢܢ� �� 80m-135n/18n
��������
�����ᷴӦ���ɶ��������Ӻ�����������ͭ���ᷴӦ������ͭ���Ӻ�ˮ��д�����ӷ�Ӧ����ʽ��ѡ��������ʱ��Ҫ�ﵽ���������ã��ֲ��������µ����ʣ�Ϊ�˵õ��ϴ��IJ�Ʒ����������Լ����������������ʣ��Լ�B����ǰ�η�Ӧ������Fe3+���ã�ʹ����ȫˮ�⣬���ɳ���������ճ�ʵ���д���Һ�õ�����IJ�������������Ũ������ȴ�ᾧ�����˵õ����壻ֱ�����վ�����в���CuCl2,����ˮ�ⷴӦ������������ù���Ϊ�Ȼ�ͭ������ͭ�Ļ�������ͭԭ���غ㣬�Ȼ�ͭ�����е�ͭ��������ù�������ͭ��ͭԭ�ӵ�������ȣ��г�����ʽ���Ȼ�ͭ���������ͭ����Է�������֮�ȵ�������֮�ȣ������ˮ��ϵ��x���ݴ˷������
(1)�������������£����ɶ��������Ӻ�����������ͭ�����������£����ɶ���ͭ���Ӻ�ˮ�����ӷ�Ӧ����ʽ�ֱ�ΪFe+2H+=Fe2++H2����CuO+2H+=Cu2++H2O��
(2)������������Fe2+����ΪFe3+,���Ҳ������µ��������ӣ�ʹ��KMnO4����K+��Mn2+��ʹ��HNO3����NO3-��������ȥ������������ʱ��������Ӧ�Ժ��������ӣ��������ʣ���ѡ�٣�
(3)Fe3++3H2O![]() Fe(OH)3+3H+,������Լ�BҪ�ܹ���ʹˮ����ȫ���У��ֲ������µ��������ӣ���ʹ��Na0H�����µ�Na+,ʹ��FeO����Fe2+,����Ϊ���壬���pH��ͬʱ�������ͭ���ӣ�û�����������룬��ѡ�ۣ�
Fe(OH)3+3H+,������Լ�BҪ�ܹ���ʹˮ����ȫ���У��ֲ������µ��������ӣ���ʹ��Na0H�����µ�Na+,ʹ��FeO����Fe2+,����Ϊ���壬���pH��ͬʱ�������ͭ���ӣ�û�����������룬��ѡ�ۣ�
(4)ѡ����Լ�B��ͨ������ķ�Ӧ����Cu2+�������Һ��pH����pHΪ4-5ʱ��Fe3+������ȫˮ�������������ʱCu2+ȴ������ˮ�⣬���Դ�ʹ��Fe3+��ȫ��������ѡ�٢ۣ�
(5)����Һ�еõ����壬һ�����������Ũ������ȴ�ᾧ�����ˣ���ʵ����Ⱥ�˳��Ϊ�ڢܢ٣�
(6)ֱ�����վ�����в���CuCl2����ˮ�ⷴӦ�����յõ�CuO��CuCl2�Ļ������²�����ȷ������һ����������ȷ���������ɵ���CuO������ͭԭ���غ�ɵã� ��
��![]() �����
�����![]() ��
��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����
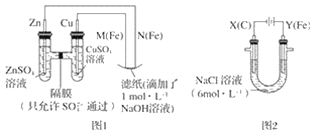
��ش�
����ͼ 1 ��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£�������� Cu ���缫����__������ĸ��ţ���
A �� B ʯī C �� D ��
��2��N ��������Ӧ�ĵ缫��ӦʽΪ__��
����ͼ 2 ��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣 �������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��3���������У�X ������Һ�� pH__����������������С����������������
��4���������У�Y �������ĵ缫��Ӧ֮һΪ Fe��6e��+8OH��= FeO42-+4H2O ���� X ���ռ���672 mL ���壬�� Y ���ռ��� 168 mL ���壨��������Ϊ��״��ʱ������������� Y �缫�����缫����������____g��
��5���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʷǰ��Ϊ������֪�����������ܡ������ʺ����ƹʳ�Ϊ��ϵԪ�ء��ش��������⣺
��1�������ܡ�����δ�ɶԵ�����Ŀ����Ϊ_____��������Χ���ӹ������ʽΪ_____��
��2��Co2�����Ժ�SCN�������γ���ɫ�����ӣ��÷�Ӧ������Co2���Ķ��Լ��顣
��SCN���Ŀռ乹��Ϊ____�����Ԫ���е�һ������������___��
��SCN����Ӧ�����������ᣨH��S��C��N�����������ᣨH��N��C��S�������������к��߷е�ϸߣ���Ҫԭ����_________________��
��3����ï����һ�ּ���ʽ�ṹ������ͨ����Ϊ����һ��Fe2�����Ӻ�����C5H5�������γɵģ�X�����о����ָ������C5H5������ƽ����ƽ�еģ��ṹ��ͼ1��ʾ��C5H5����̼ԭ�ӵ��ӻ�����Ϊ_____�������еĴ������̿��÷���![]() ��ʾ������m���������γɵĴ�����ԭ������n���������γɵĴ������̵���������C5H5���еĴ������̿��Ա�ʾΪ______��
��ʾ������m���������γɵĴ�����ԭ������n���������γɵĴ������̵���������C5H5���еĴ������̿��Ա�ʾΪ______��
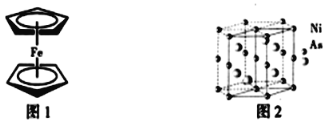
��4��NiAs�����е�ԭ�Ӷѻ���ʽ��ͼ2��ʾ������As����λ��Ϊ______���������ױ߱߳�Ϊa cm����Ϊc cm�������ӵ�������ֵΪNA��NiAs���ܶ�Ϊ______g��cm��3�����г�����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���Ʊ�SO2��̽��SO2��������ʣ������������ͼװ�ã��г�����ʡ�ԣ���

(1)ʵ����Ҫ��Լ100mL��1:1���ᣨŨ�������ܼ�ˮ������ȣ������Ƹ�����ʱ��Ҫ�IJ��������ǣ���������______��_______�����ƹ���_______________________________��
(2)ͼ��װ��A��������________________________________��
(3)����Ҫ�Աȸ���SO2��ʪ���SO2��Ư���ԣ������������Ҫ������Լ��ֱ��ǣ�
C��_____________D��_________ E��Ʒ����Һ F��NaOH��Һ
����Ҫ�Ⱥ���֤SO2���������뻹ԭ�ԣ������������Ҫ������Լ��ֱ��ǣ�
C����ƿ D��_____________ E��_________ F��NaOH��Һ
д����֤SO2��ԭ��װ���е����ӷ�Ӧ����ʽ__________________________________��
(4)���������ױ������������з��������һ��ʵ������ͼ�ⶨ�������Ƶ���������������Ʒ����ΪW�ˣ�����ͼ�������£���Ҫ�ⶨ�����������趨���ű�ʾ���г������������������ļ������ʽ___________________����˵�������ŵ����壺________________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֱ����������ˮ��������Ҳ������ȡƯ�۾����������Ƶ�������������ˮ������
(1)����ͨ��ˮ�п�����ɱ������������ɱ��������ԭ����___������Ч�ɷֵĵ���ʽ��____��
(2)������������ȡƯ�۾����������������������������������Ӧ������ֻ�ܱ�����������������Ϊ�ˣ��ڹ�ҵ�ϲ��ü�������ˮ����ʯ���������Ȼ�����ԭ����____��
(3)Ư�۾�������������ˮ��pHӰ�죬pH��Сʱ����������____����������������С������ ��pH��ʱ��������������ԭ����______��
(4)������������ˮ���������ö࣬����Ӱ�����彡���л������������������ȡ�������ƾ�ˮ��___Fe3++____ ��__________�� + ___Cl2��___FeO42-+____ +___H2O
��ȫȱ�����ƽ�������ӷ���ʽ��
(5)����Na2FeO4������Ч�ʣ��Ե�λ�����õ��ĵ�������ʾ��Լ������____����˵���þ�ˮ����������Ƚ��к���Խ�� _______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��amolFeS��bmolFe3O4Ͷ�뵽VL cmol/L��������Һ��ǡ����ȫ��Ӧ������ֻ����NO���塣���ó�����Һ�ijɷ���Fe��NO3��3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ������Ϊ
A.![]()
B.��a+3b��mol
C.![]()
D.��cV��3a��9b��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶���,�������PH��ͬ������ʹ�����Һ�ֱ��ˮϡ��,��Һ�е�����Һ����仯��������ͼ��ʾ����ͼ�ж�����˵����ȷ����

A.b�������Ũ�ȴ���a�������Ũ��
B.b����Һ�ĵ����Ա�c����Һ�ĵ�������
C.ȡ�������a�㡢b���Ӧ����Һ,���ĵ�NaOH������ͬ
D.���ߢ��ʾ��������ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ����������(����)
A.c(Fe3+)��0.1 mol��L��1����Һ�У�Na+��Cu2+��Cl����SCN��
B.ʹ���ȱ��ɫ����Һ�У�K+��Fe2+��Cl����MnO4��
C.��ˮ�������c(H+)=10��12mol��L��1����Һ��Na+��K+��CO32����SO42��
D.![]() ��10��12����Һ�У�Mg2+��Al3+��NO3����SO42��
��10��12����Һ�У�Mg2+��Al3+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ըɺ���Ϊԭ����ȡ�ⵥ�ʺ��Ȼ��صĹ�����Ҫ�����������������գ�
��1������һ�����ոɺ�����ʹ��һ�������ˮ���ݡ����ˣ��Ƶ�ԭ��Һ�������Ȼ��ص����ʡ�ʵ�������պ���Ӧ����_____________(��д��������)�м��ȣ�ѡ����ˮ��������ˮ���ݺ����ҵ�Ŀ����____��
��2���������ԭ��Һ���ᾧ���˷�����Ȼ��غ�����Һ��ͨ������������I�����Ƶø�����Һ��ʵ����ģ���������̵�ʵ��װ����ͼ��ʾ��
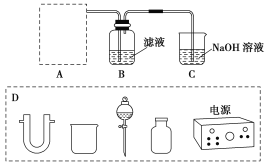
װ����A����������ȡ������ʵ������ȡ����ͨ�������ַ�����һ����ǿ����������������������Cl�������ǵ�ⷨ������ͼD�е�����(֧�����������ܡ����ߡ�ʯī������Ƥ������)����ʵ�ֵķ�Ӧ��________(ѡ����)��
a��2NaCl(s)��MnO2��2H2SO4(Ũ)����MnSO4��Cl2����Na2SO4��2H2O
b��2KMnO4��16HCl(Ũ)��2MnCl2��2KCl��5Cl2����8H2O
c��2NaCl��2H2Oͨ��2NaOH��Cl2����H2��
d��4HCl(Ũ)��MnO2����MnCl2��Cl2����2H2O
���ƿB�з�����Ӧ�����ӷ���ʽ��____________��װ��C��NaOH��������_______________��
��3����������ȡ100 mL B�и�����Һ�����������̷���ⵥ�ʡ�
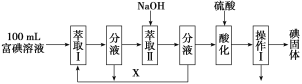
��ȡ����ữ���̷����ķ�Ӧ�ֱ��ǣ�
3I2��6OH����5I����IO3-��3H2O��
5I����IO3-��6H����3I2��3H2O��
��ȡ��XӦѡ��________(ѡ����)��
a��100 mL�� b��10 mL�Ҵ� c��10 mL CCl4 d��10 mL��ϩ
ʵ���ҽ�����ȡ������������________���������������________��
��4���������KCl��Ʒ�г���������NaCl��K2CO3�����ʣ����ʵ���ó������ⶨ�Ȼ�����Ʒ��K2CO3��������������Ҫ�õ��Ļ�ѧ�Լ���_________(��д��ѧʽ)����Ҫ�ⶨ����������________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com