
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| ||
| 6min |
| c(CO2)?c(H2) |
| c(H2O)?c(CO) |
| 0.2×0.2 |
| 0.3×0.8 |
| 1.6mol |
| 4mol |
| 0.4mol |
| 0.4mol |


科目:高中化学 来源: 题型:
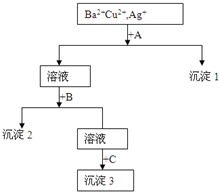 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图所示
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图所示查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=448 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.12 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com