
分析 (1)用惰性电极电解饱和氯化钠溶液,阴极上水得电子生成氢气和氢氧根离子,阳极上氯离子失电子生成氯气;
(2)电解后溶液中溶质为NaOH,溶剂是水,设NaOH的物质的量为xmol,水的物质的量为ymol,根据O原子守恒知,n(O)=n(NaOH)+n(H2O)=(x+y)mol,O元素质量分数=$\frac{16g/mol×(x+y)mol}{40xg+18yg}×100%$=80%,据此计算x、y之比;
(3)根据方程式知2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,n(Cl2)=n(H2)=$\frac{1}{2}$n(NaOH),根据NaOH计算析出HCl的质量,结合溶液密度计算溶液体积,根据Na原子守恒计算n(NaCl),从而计算原溶液物质的量浓度.
解答 解:(1)用惰性电极电解饱和氯化钠溶液,阴极上水得电子生成氢气和氢氧根离子,阳极上氯离子失电子生成氯气,电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
(2)电解后溶液中溶质为NaOH,溶剂是水,设NaOH的物质的量为xmol,水的物质的量为ymol,根据O原子守恒知,n(O)=n(NaOH)+n(H2O)=(x+y)mol,O元素质量分数=$\frac{16g/mol×(x+y)mol}{40xg+18yg}×100%$=80%,
x:y=1:10,故答案为:1:10;
(3)设电解后溶质的物质的量为1mol、溶剂的物质的量为10mol,
根据方程式知2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,n(Cl2)=n(H2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×1mol=0.5mol,
析出气体相对于HCl,则析出气体质量=0.5mol×2×36.5g/mol=36.5g,原溶液质量=40g/mol×1mol+18g/mol×10mol+36.5g=256.5g,溶液体积=$\frac{256.5g}{1.15g/mL}$=0.223L,
根据Na原子守恒得n(NaCl)=n(NaOH)=1mol,则c(NaCl)=$\frac{1mol}{0.223L}$=4.48mol/L,
答:原氯化钠溶液的物质的量浓度4.48mol/L.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间关系是解本题关键,注意电解后溶液中溶质成分,注意原溶液质包含生成气体质量,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
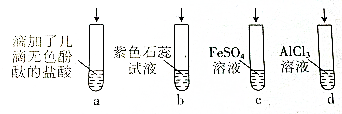
| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
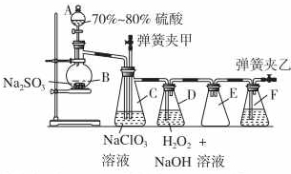 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 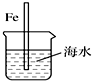 图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. |  图中,发生吸氧腐蚀 | |
| C. | 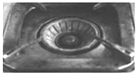 图中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 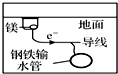 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能 | |
| B. | 对于某一反应aA+bB=cC+dD,△H单位中的mol-1是指每摩尔(aA+bB=cC+dD)反应 | |
| C. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| D. | 甲烷分子具有正四面体结构的原因是碳原子的2S轨道与2P轨道发生SP杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 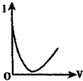 | B. | 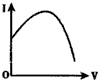 | C. | 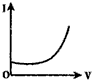 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 铁粉跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com