
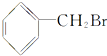
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
分析 该物质中含有苯环和溴原子,具有苯和卤代烃的性质,能发生加成反应、氧化反应、还原反应、取代反应,据此分析解答.
解答 解:A.该分子中含有苯环,且只有一个碳原子连接苯环,所以所有碳原子位于同一平面上,故A正确;
B.该分子中溴原子能发生取代反应,但连接溴原子碳原子相邻碳原子上不含氢原子,所以不能发生消去反应,故B正确;
C.该物质中不含自由移动的溴离子,所以不能和硝酸银溶液反应生成淡黄色沉淀,故C错误;
D.该物质中含有苯环,所以能发生加成反应,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意卤代烃发生消去反应的条件,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- | |
| B. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| C. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| D. | 0.1mol•L-1NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
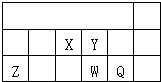 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置R如上表所示;下列说法
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置R如上表所示;下列说法| A. | X的最高价氧化物的水化物不能与它的氢化物反应 | |
| B. | Y原子的电子总数是其K层电子数的3倍 | |
| C. | Z在高温下可与铁的氧化物发生铝热反应 | |
| D. | Q的单质能与W的氢化物发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH=CH3COO-+H+ | B. | NaOH=Na++OH- | ||
| C. | NH4Cl?NH4++Cl- | D. | NaHCO3=Na++H++CO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | - |
| 最低负价 | - | -1 | - | - | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | M(OH)2的碱性比XOH的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com