
| 装置 |  |  | 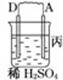 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
分析 (1)甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
(2)乙中C的质量增加,说明C上B离子得电子发生还原反应,则C作原电池正极,B作负极;
(3)作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C.
解答 解:(1)该装置中,二价金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A-2e-═A2+,
故答案为:A-2e-═A2+;
(2)乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,故答案为:D>A>B>C.
点评 本题考查了原电池原理,根据原电池电极上得失电子来判断正负极,一般来说,作原电池负极的金属金属活动性顺序强,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于A的说法正确的是( )
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于A的说法正确的是( )| A. | 化合物A的分子式为C15H22O3 | |
| B. | 与FeCl3溶液发生反应后溶液显紫色 | |
| C. | 1 mol A最多可以与2 mol Cu(OH)2反应 | |
| D. | 1 mol A最多与1 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定没有甲烷 | B. | 一定没有乙烷 | ||
| C. | 可能是甲烷和乙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氨水含有NA个NH3分子 | |
| B. | 标准状况下,11.2L水中含有分子数目为0.5NA | |
| C. | 22.4LO2中含有氧分子的个数为NA | |
| D. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com