
【题目】(1)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO![]() 的物质的量浓度为mol·L-1
的物质的量浓度为mol·L-1
(2)标况下,mg气体A和ng气体B具有相等的体积,则同温同压下的密度之比为________,同质量的A、B的分子数目之比为________。
(3)在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为___、____。
(4)相同条件下,某Cl2与O2混合气体100ml恰好与150mlH2化合成HCl和H2O,则混合气体中Cl2与O2的体积比为,混合气体的平均摩尔质量为。
(5)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的体积分数为,若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为。(计算结果保留三位有效数字)
【答案】(1)3m/112V(2)(1)m∶nn∶m
(3)6.4mol0.2mol(4)1:151.5g·mol-1(5)25%48.3%
【解析】
试题分析:(1)mgFe3+的物质的量为![]() =m/56mol,则该溶液中Fe3+的物质的量浓度为
=m/56mol,则该溶液中Fe3+的物质的量浓度为![]() mol/L;根据电荷守恒可知3c(Fe3+)=2c(SO2-4),故c(SO2-4)=3/2c(Fe3+)=3/2×
mol/L;根据电荷守恒可知3c(Fe3+)=2c(SO2-4),故c(SO2-4)=3/2c(Fe3+)=3/2×![]() mol/L=3m/112Vmol/L;
mol/L=3m/112Vmol/L;
(2)同温同压,气体密度之比等于摩尔质量之比等于相对分子质量之比,即为m:n;A与B相对分子质量之比为m:n,同质量时由n=m/M可知,分子数之比等于1/m:1/n=n:m;
(3)在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,该培养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol;需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾中提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol;
(4)设氯气的气体为x,氧气的体积为(100mL-x),则:
Cl2+H2![]() 2HCl2H2+O2
2HCl2H2+O2![]() 2H2O
2H2O
xx2(100mL-x)(100mL-x)
所以,x+2(100mL-x)=150mL解得:x=50mL,氧气的体积为100mL-50mL=50mL,所以,混合气体中Cl2和O2的体积之比为50mL:50mL=1:1.假设氯气和氧气各1摩尔,则混合气体的平均摩尔质量为(71g+32g)÷2mol=51.5g/mol;
(5)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),整理得x:y=3:1,故氧气的体积分数为x/(x+y)×100%=25%;其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为![]() ×100%=48.3%。
×100%=48.3%。


科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)根据如图所示情况,判断下列说法中正确的是 。
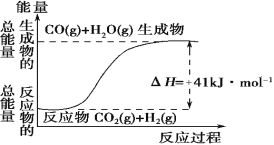
A.其热化学方程式为:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为 。
②已知反应2HI(g)![]() H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
③Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是( )
①溴乙烷与氢氧化钠水溶液共热 ②溴乙烷与氢氧化钠的乙醇溶液共热
③甲烷与氯气 ④乙炔与氯化氢在一定条件下制氯乙烯
A.①②
B.②④
C.①④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与溴的四氯化碳溶液反应生成CHBr2CBr2CH2CH3 , 则与该烃不同类别的同分异构体是( )
A.CH≡CCH2CH3
B.CH3C≡CCH3
C.CH3CH2CH2CH3
D.CH2=CHCH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O![]() Fe(OH)3↓+3 H+
Fe(OH)3↓+3 H+
B.澄清石灰水与稀盐酸反应Ca(OH)2 + 2 H+ ═ Ca2+ + 2 H2O
C.稀硫酸除铁锈:Fe2O3 + 6 H+ == 2 Fe3+ + 3 H2O
D.硫酸和Ba(OH)2反应: Ba2+ + OH- + SO42- + H+ = BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①中国古代四大发明之一的黑火药,它是由硫磺、木炭粉和硝石组成;②油条中铝含量超标十分普遍,是影响人们健康的食品安全隐患。油条无铝配方由碳酸氢钠(小苏打)和臭粉组成。下列关于硝石和臭粉的成份组合正确的是
A.KNO3、NH4HCO3
B. KNO3、Na2CO3
C. HNO3、(NH4)2CO3
D.NH4NO3、Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com