
【题目】在密闭容器中,使2 mol A和4 mol B混合发生下列反应:
A(g)+2B(g) ![]() 2C(g) ΔH<0。
2C(g) ΔH<0。
(1)当反应达到平衡时,A和B的浓度比是_______;A和B的转化率比是_______。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_________,密度_________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
【答案】1∶2 1∶1 变小 不变 逆向 向左移动 小于
【解析】
(1)对于A(g)+2B(g) ![]() 2C(g) ΔH<0,在密闭容器中,开始时注入2molA和4molB,发生反应时消耗A和B始终按照1∶2进行,据此分析判断;
2C(g) ΔH<0,在密闭容器中,开始时注入2molA和4molB,发生反应时消耗A和B始终按照1∶2进行,据此分析判断;
(2)根据升高平衡体系的温度时,平衡向逆反应方向移动,根据混合气体的平均相对分子质量![]() =
=![]() ,密度ρ=
,密度ρ=![]() 判断;
判断;
(3)恒压容器中加入惰气,为保持压强不变,容器体积增大,相当于减小压强,据此分析判断;
(4)根据勒夏特列原理解答,若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡向体系温度降低的方向移动,据此分析解答。
(1)对于A(g)+2B(g) ![]() 2C(g) ΔH<0,在密闭容器中,开始时注入2molA和4molB,发生反应时消耗A和B始终按照1∶2进行,所以当反应达到平衡时,剩余A和B的物质的量之比为1∶2,浓度之比也为1∶2;又转化率=
2C(g) ΔH<0,在密闭容器中,开始时注入2molA和4molB,发生反应时消耗A和B始终按照1∶2进行,所以当反应达到平衡时,剩余A和B的物质的量之比为1∶2,浓度之比也为1∶2;又转化率=![]() ,所以A和B的转化率之比为1∶1,故答案为:1∶2;1∶1;
,所以A和B的转化率之比为1∶1,故答案为:1∶2;1∶1;
(2)因为该反应为放热反应,则升高平衡体系的温度时,平衡向逆反应方向移动,气体的物质的量变大,质量不变,所以混合气体的平均相对分子质量![]() =
=![]() 减小,又容器体积不变,所以密度ρ=
减小,又容器体积不变,所以密度ρ=![]() 不变,故答案为:变小;不变;
不变,故答案为:变小;不变;
(3)当达到平衡时,充入氩气,并保持压强不变,体积增大,相当于体系的压强减小,平衡向气体体积增大的方向移动,该反应是气体体积减小的反应,所以平衡逆向移动,故答案为:逆向;
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,该反应为放热反应,升高温度,平衡向吸热的方向移动,即平衡向左移动,使体系温度降低,达到新平衡后,容器内温度小于原来的2倍,故答案为:向左移动;小于。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列物质间有如下转化关系,请按要求填空。
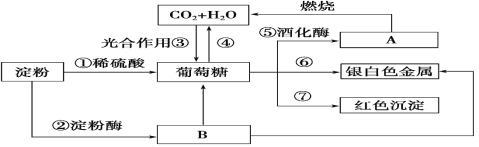
(1)在制镜工业和热水瓶胆镀银时,常利用上述反应________(填序号)。
(2)反应①②的反应类型为_______(填选项字母)。
A.氧化反应 B.加成反应 C.水解反应 D.消去反应
(3)反应⑦可用于检验糖尿病病人尿液中的含糖量,该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨酸醇(A)和异山梨酸醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:

回答下列问题:
(1)葡萄糖的分子式为______;A中含有的官能团的名称为_______。
(2)C的结构简式为_______;由B到C的反应类型为____。
(3)由D到E的反应方程式为:_________。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),F的可能结构有_____种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是

A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要在干燥的氯化氢气流低温小火烘干
D.溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、④、⑤中均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得到的曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将装满气体X的试管倒置于装有液体Y的水槽中,充分振荡试管后,下列说法合理的是
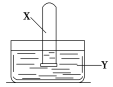
气体X | 液体Y | 试管内现象 | |
A | SO2 | 滴有品红的水溶液 | 无明显现象 |
B | NO2 | 水 | 充满无色溶液 |
C | NH3 | 滴有酚酞的水溶液 | 充满红色溶液 |
D | C2H4 | 酸性KMnO4溶液 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 是原子序数依次增大的同一短同期元素,A、B 是金属元素,C、D 是非金属元素,A、B的最高价氧化物对应的水化物可以发生反应生成盐和水。
(1)A 与 C 可形成化合物 A2C,写出该化合物的电子式为_____。
(2)B 与 D 形成的化合物是_____(填“离子化合物”或“共价化合物”),验证该结 论的实验方法是_____。
(3)C 的低价氧化物通入 D 单质的水溶液中,发生反应的化学方程式为_____。
(4)用 C 的最高价含氧酸 W 的溶液作电解质溶液(物质的量浓度为 5.2mol/L,体积为1L, 假设反应前后溶液体积变化忽略不计)组装成原电池如图所示。

①在 a 电极上发生的反应可表示为_____。
②若电池工作一段时间后,a 极消耗 0.05molPb, b 电极的质量变化为________g,则此时 W 溶液的浓度 为___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物NOx(主要指NO和NO2)会形成酸雨、光化学烟雾,破坏臭氧层,是大气主要污染物之一,有效去除大气中的NOx是环境保护的重要课题。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
②为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内υ(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后NO的转化率α1=____。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”)。
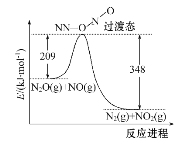
(2)NO能与N2O反应生成N2和NO2,反应的能量变化如下图所示,若生成1 mol N2,其ΔH=____kJ·mol-1。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。
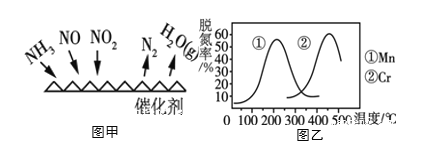
①由图甲可知,SCR技术中的氧化剂为_____________。当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为______________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂为________。
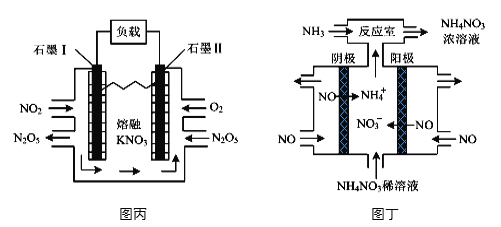
(4)利用电化学装置可消除氮氧化物污染,变废为宝。图丙装置实现的能量转化形式是_______。图丁为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水作氧化剂的是________。
A.Cl2+H2OHCl+HClO
B.NaH+H2O=NaOH+H2↑
C.3Fe+4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
D. H2+CuO![]() H2O+Cu
H2O+Cu
E. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com