
| 64a-b |
| 64 |
| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
 Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)
Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)

查看答案和解析>>
科目:高中化学 来源: 题型:

| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
查看答案和解析>>
科目:高中化学 来源: 题型:
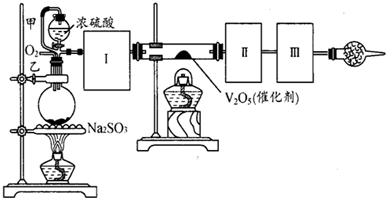
(14分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4+ H2O + SO2↑
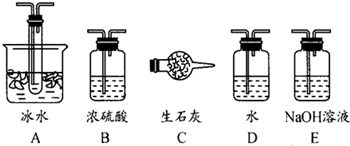
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ处连接的装置分别是__、__、__。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作顺序是 。
(3)甲处导管的作用是 。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是 。
查看答案和解析>>
科目:高中化学 来源:2010年河北省高二第二学期期中考试化学试题 题型:实验题
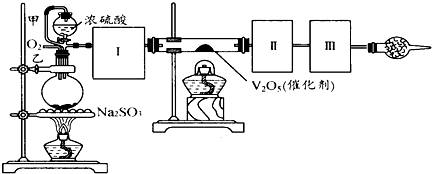
(14分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑

(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ处连接的装置分别是__、__、__。

(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作顺序是 。
(3)甲处导管的作用是 。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com