
【题目】实验需要0.80 mol·L-1NaOH溶液475 mL和0.40 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
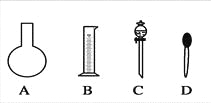
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,不能用容量瓶实现的有______________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.量取一定体积的液体 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_________(填”大于”、“等于”或“小于”,下同)0.8 mol·L-1。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度__________0.8 mol·L-1。
(4)根据计算得知,所需质量分数为98 %、密度为1.84 mol·L-1的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,选用___________mL量筒最好。
【答案】(1)AC;(2分)烧杯、玻璃棒、500mL容量瓶;(3分)
(2)BCEF ;(4分,一个1分,多选不给分)
(3)16.0;大于;等于;(各2分,共6分)
(4)10.9;15(各2分,共4分)
【解析】试题分析:(1)实验室配制一定体积、一定物质的量浓度的溶液,需要使用的仪器有天平、药匙、量筒、烧杯、玻璃棒、容量瓶、胶头滴管。故如图所示的仪器中配制溶液肯定不需要的是烧瓶和分液漏斗,选项是A、C;配制上述溶液还需用到的玻璃仪器是烧杯,玻璃棒;(2)容量瓶所具备的功能是A.配制一定体积准确浓度的标准溶液;B.量取一定体积的液体,不具备是功能是C.测量容量瓶规格以下的任意体积的液体;D.准确稀释某一浓度的溶液;E.贮存溶液;F.用来加热溶解固体溶质。故选项是C、D、E、F。(3)质量分数为98%、密度为1.84 g/cm3的浓硫酸的物质的量浓度是C=![]() mol/L溶液在稀释前后溶质的物质的量不变。由于有500mL的容量瓶,所以根据稀释公式C1V1=C2V2可得V1= (C2V2)÷C1="(0.40mol/L×500mL)" ÷18.4mol/L=10.9ml。仪器在使用使,规格与量取的物质的体积越接近,误差就越小,所以应选用15mL的量筒;(4)浓硫酸的浓度=c=103*1.84*98%/98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L*V=0.4mol/L*0.5L,V=0。0109L=10。9ml,选取的量筒规格应该等于或大于量取溶液体积,故选15ml量筒,故答案为10.9;15
mol/L溶液在稀释前后溶质的物质的量不变。由于有500mL的容量瓶,所以根据稀释公式C1V1=C2V2可得V1= (C2V2)÷C1="(0.40mol/L×500mL)" ÷18.4mol/L=10.9ml。仪器在使用使,规格与量取的物质的体积越接近,误差就越小,所以应选用15mL的量筒;(4)浓硫酸的浓度=c=103*1.84*98%/98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L*V=0.4mol/L*0.5L,V=0。0109L=10。9ml,选取的量筒规格应该等于或大于量取溶液体积,故选15ml量筒,故答案为10.9;15


科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是________________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中大球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是_________。
(6)若晶胞的棱长为a cm ,则R2M晶体的密度为=___________g·cm–3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用SiO2与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1。下列说法正确的是( )
A.硅元素在地壳中含量居第二位,主要以单质硅和硅酸盐的形式存在
B.纯净的SiO2只能用于制造光导纤维
C.SiC因有很高的化学稳定性和热稳定性,故可用作高温结构陶瓷材料。
D.制造粗硅时的上述反应方程式为:2SiO2+5C![]() Si+SiC+4CO↑
Si+SiC+4CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
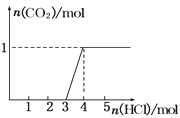
A.通入的CO2气体为22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g/cm3),所得溶液的密度为ρg/cm3,质量分数为ω,物质的量浓度为cmol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度:c=1 mol/L
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:ω=36.5c/1 000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏和煤的液化均是物理变化
B.天然纤维和合成纤维的主要成分都是纤维素
C.海水淡化的方法有蒸馏法、电渗析法等
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
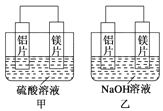
(1)写出甲中正极的电极反应式___________________。
(2)乙中总反应的离子方程式:________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出_____________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有______________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3 | H2PO4- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 1 | 0.35 | 1 | 2 | 1 | 0.25 | 1 |
A.Ca2+B.SO42-C.Zn2+D.H2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O2(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
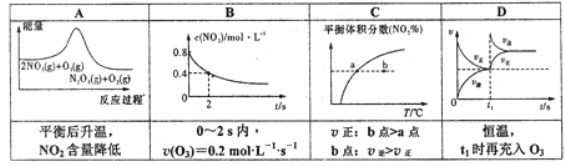
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com