
|
硫酸镁、硫酸铝两种物质组成的溶液100mL中,SO42-物质的量浓度为0.10mol/L,加入0.30mol/LNaOH100mL溶液到生成的白色沉淀恰好不再溶解为止.过滤,在所得滤液中AlO2-物质的量浓度为 | |
| [ ] | |
A. |
0.025mol/L |
B. |
0.10mol/L |
C. |
0.050mol/L |
D. |
0.25mol/L |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 Al Al 元素假设②:该混合金属粉末中除镁外还含有 Zn Zn 元素假设③:该混合金属粉末中除镁外还含有铝、锌元素 ●实验探究: 甲同学基于假设③设计实验方案如下:乙同学同样基于假设③设计另一实验方案如下: 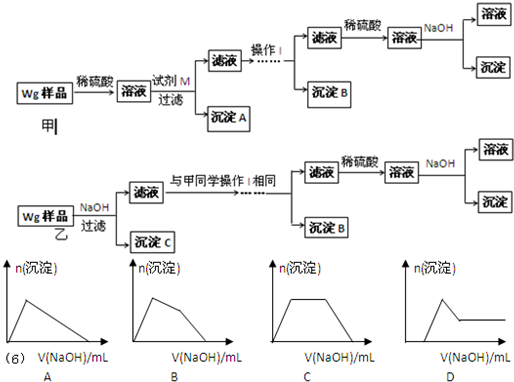 (2)试剂M是 NaOH溶液 NaOH溶液 ;沉淀B是Al(OH)3 Al(OH)3 .(3)丙同学认为乙同学的方案比甲同学的好,理由是 步骤简单,节约试剂 步骤简单,节约试剂 .(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 将沉淀C洗涤、小心干燥后称量 将沉淀C洗涤、小心干燥后称量 .(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 稀硫酸 稀硫酸 ,直至生成的沉淀刚好溶解,再加入足量的稀氨水 稀氨水 .(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图象正确的是 B B .
查看答案和解析>> 科目:高中化学 来源: 题型: (2013?合肥一模)MgSO4?7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.其主要工艺如下: 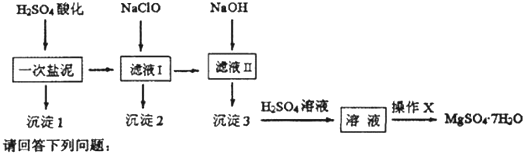 (1)用H2SO4调节溶液PH至1~2,H2SO4作用是 将盐泥中的碳酸盐和硅酸盐转化为可溶性的硫酸盐,同时生成硫酸钙和硅酸除去 将盐泥中的碳酸盐和硅酸盐转化为可溶性的硫酸盐,同时生成硫酸钙和硅酸除去 .(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 Fe(OH)3 Fe(OH)3 、Al(OH)3 Al(OH)3 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为ClO-+Mn2++H2O=MnO2+Cl-+2H+ ClO-+Mn2++H2O=MnO2+Cl-+2H+ .(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 取滤液Ⅱ1-2ml于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中 无Fe3+ 取滤液Ⅱ1-2ml于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中 无Fe3+ .(4)“操作X”是将溶液 蒸发浓缩 蒸发浓缩 、冷凝结晶 冷凝结晶 、过滤洗涤,即得到MgSO4?7H2O晶体.(5)准确称量制得的样品5g,用200mL水溶解,加入2mol?L-1的盐酸5mL,在不断搅拌下滴加足量2mol?L-1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 98.4% 98.4% .查看答案和解析>> 科目:高中化学 来源: 题型: 某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在. 所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O. 探究过程: ●查阅资料:
|