
| A. | 乙酸乙酯 | B. | 汽油 | C. | 乙酸 | D. | 植物油 |
科目:高中化学 来源: 题型:选择题
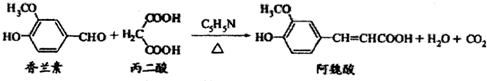
| A. | 1mol阿魏酸与足量溴水反应,消耗1molBr2 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、水解反应 | |
| D. | 香兰素与足量氢气完全反应后的产物,其1个分子中含有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
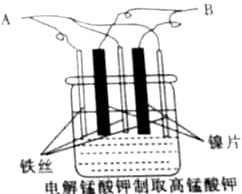 制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| B. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| C. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| D. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器内压强不再变化,则说明该反应己达平衡 | |
| B. | 反应前H2S物质的量为2.5mol | |
| C. | CO和H2S达平衡后的转化率相同 | |
| D. | 若平衡后再加入CO,则正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纸电池是一种有广泛应用的“软电池”,如图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是( )
纸电池是一种有广泛应用的“软电池”,如图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是( )| A. | Zn为负极,进行氧化反应 | |
| B. | 电池工作时,电子由MnO2流向Zn | |
| C. | 正极反应:MnO2+e-+H2O═MnO(OH)+OH- | |
| D. | 电池总反应:Zn+2MnO2+2H2O═Zn(OH)2+2MnO(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
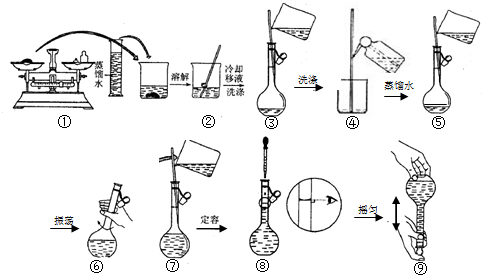
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
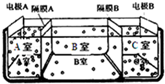 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
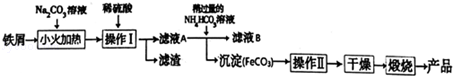
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com