
可选用药品:MgCl2·6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。
仪器:如下图所示(装置可重复使用)。回答下列问题:
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B……填入)是________,有关的化学方程式是________;

(2)按HCl气流方向,其余装置的连接顺序(用数学1、2……填入)是:
( )→( )( )→( )( )→( )( );
(3)各装置中应放的药品:A________B________C________D________E________;
(4)B装置的作用是________,B中能观察到的现象是________。
| (1)C、E
NaCl+H2SO4(浓) (2)⑤→①②→⑥⑦[或⑦⑥]→④③ (3)A:浓H2SO4 B:稀NaOH C:固体NaCl D:MgCl2·H2O E:浓H2SO4 (4)尾气吸收,防止污染环境;白雾。
|
| (1)氯化氢气体的制备反应以及气体发生装置。与课本中实验室制取氯化氢完全相同,考生应比较熟悉。
(2)注意题中给的信息,MgCl2·6H2O在干燥的 HCl气流中加热才能制得无水MgCl2,因此从发生器中出来的HCl气体须经过洗气瓶A,用浓H2SO4干燥,再进入装有MgCl2·6H2O的反应管D中。最后。从反应管D出来的尾气中含有水汽和大量未反应的HCl气体,为防止尾气中的HCl气体污染环境,需要通过装有稀NaOH溶液的装置B吸收尾气;由于HCl气体极易溶于水,所以出来的气体遇水蒸气呈雾状盐酸微小液珠。
|


科目:高中化学 来源: 题型:058
以MgCl2·6H2O为原料制备无水氯化镁。已知:MgCl2·6H2O晶体在空气中加热时,释出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热能制得无水MgCl2。
可选用药品:MgCl2·6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。
仪器:如下图所示(装置可重复使用)。回答下列问题:
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B……填入)是________,有关的化学方程式是________;

(2)按HCl气流方向,其余装置的连接顺序(用数学1、2……填入)是:
( )→( )( )→( )( )→( )( );
(3)各装置中应放的药品:A________B________C________D________E________;
(4)B装置的作用是________,B中能观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:在实验中,常常利用高沸点酸制低沸点酸。以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。已知MgCl2·6H2O晶体在空气中加热时,释放出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热,能制得无水MgCl2。
可选用药品:MgCl2·6H2O晶体、NaCl(s)、KClO3(s)、MnO2、浓H2SO4、浓盐酸、稀NaOH溶液。
 仪器如图所示(装置可重复使用)。回答下列问题:
仪器如图所示(装置可重复使用)。回答下列问题:
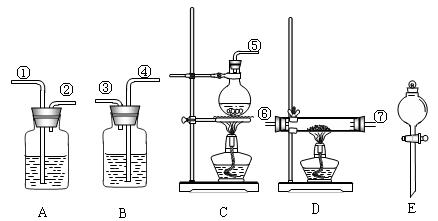
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B等填入)是 ,
有关的化学方程式是 。
(2)按气流方向,其余装置的连接顺序(用数字①、②等填入)是:
( )→( )( )→ ( )( )→( )( )
(3)各装置中应放的药品: B.______,D.______,E.______。
(4)B装置的作用是_________________。
(5)从实验安全角度考虑,上述所给药品和仪器设计的实验存在不足,请你提出修改建议: 。
查看答案和解析>>
科目:高中化学 来源:2011届安徽省宣城市高三第二次调研测试(理综)化学部分 题型:填空题
(14分)镁及其化合物在生产生活中有重要的作用。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下: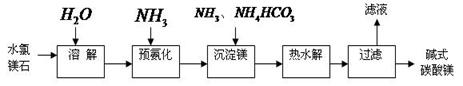
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。指出该物质在工农业生产中的一种用途: 。
(2)写出预氨化时发生的主要反应的离子方程式: 。
(3)沉淀镁时反应的温度不宜过高,原因是 。
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③ ;④ ;⑤称量MgO。
18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a= ;b = ;c = 。
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁。有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则。你同意该同学的想法吗?为什么?你的观点是 。理由是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年安徽省宣城市高三第二次调研测试(理综)化学部分 题型:填空题
(14分)镁及其化合物在生产生活中有重要的作用。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
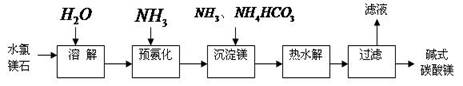
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。指出该物质在工农业生产中的一种用途: 。
(2)写出预氨化时发生的主要反应的离子方程式: 。
(3)沉淀镁时反应的温度不宜过高,原因是 。
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③ ;④ ;⑤称量MgO。
18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a= ;b = ;c = 。
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁。有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则。你同意该同学的想法吗?为什么?你的观点是 。理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com