
在BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入下列四种气体①Cl2 ②NH3 ③NO2 ④H2S均会产生沉淀。
回答下列问题:
(1)通入四种气体时产生的沉淀分别是
①______________;②_____________;③_____________;④_____________。
(2)用方程式表示①和④产生沉淀的原因
①________________________________________________________________________;
②________________________________________________________________________。
科目:高中化学 来源: 题型:
向50 g浓度为c mol·L-1、密度为ρ g·cm-3的氨水中加入一定量的水,将其稀释至0.5c mol·L-1,则加入水的体积( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列几组化合物的熔、沸点由高到低的顺序,并简要说明判断理由。
(1)CCl4、CF4、CBr4、CI4:_______________________________________________
________________________________________________________________________
__________________________________。
(2)乙醇、溴乙烷、乙烷:________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是( )
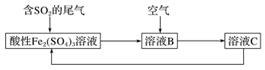
A.溶液B中发生的反应为2SO2+O2===2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe2+
C.由以上流程可推知氧化性:Fe3+>O2>SO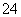
D.此工艺的优点之一是物质能循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
右图表示某固态
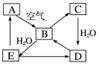
单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式:
________________________________________________________________________。
(2)写出E与A的氢化物反应生成A的化学方程式:
________________________________________________________________________。
(3)写出一个由D生成B的化学方程式:
________________________________________________________________________。
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式:_______________________________________________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________________________________________________________________________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为了便于监控,实施环境保护,下列适合测定硫酸尾气中SO2含量的试剂是( )
A.品红溶液 B.碘水、淀粉溶液
C.氨水、酚酞试液 D.以上都能
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)__________________________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____________。
(2)L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为__________________________________________。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:__________________________________________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为________________________,向Y中加足量稀硫酸后,再加高锰酸钾溶液,高锰酸钾溶液褪色。写出使高锰酸钾溶液褪色的反应的离子方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com