
分析 ①二氧化氮有毒,容易造成光化学烟雾;
②含有重金属离子的水有毒,不能直接排放;
③汽车尾气中的CO和NO在催化剂的作用下可转化为无害气体是氮气和二氧化碳,化学方程式为
解答 解:①二氧化氮有毒,容易造成光化学烟雾;氮气、二氧化碳不是污染物;
故选:a;
②Cr2O72- 和Pb2+,都是重金属离子,能引起污染;
故选:c;
③汽车尾气中的CO和NO在催化剂的作用下可转化为无害气体是氮气和二氧化碳,所以化学方程式为2CO+2NO $\frac{\underline{\;\;△\;\;}}{\;}$ N2+2CO2,故答案为:2CO+2NO $\frac{\underline{\;\;△\;\;}}{\;}$ N2+2CO2.
点评 本题考查了生活中常见的污染和治理,熟悉相关知识是解题关键,题目难度不大,注意对相关内容的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫做该物质的热值 | |
| B. | 把FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| C. | 用25mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 太阳能电池是把太阳能转化为内能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950 mL,76 g | B. | 500 mL,80 g | C. | 1000 mL,80 g | D. | 1000 mL,76 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
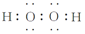
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
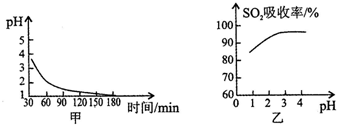 2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.
2SO2(g)+2O2(g)?2SO3(g)是生产硫酸的主要反应之一.下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率.| 温度/ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com