
| A. | 溶液中含有1mol CuSO4 | |
| B. | 1L水中加入160g CuSO4 | |
| C. | 1mol CuSO4溶于1mol水中 | |
| D. | 将250g CuSO4•5H2O溶于少量水后再稀释成1000mL |
分析 1mol/L硫酸铜溶液是指1L溶液中含有溶质硫酸铜1mol,据此分析判断选项.
解答 解:A、1L溶液中含有1mol CuSO4,溶液体积不同,溶质物质的量不同,故A错误;
B、1L水中加入160g CuSO4,溶质物质的量=$\frac{160g}{160g/mol}$=1mol,溶液体积大于1L,浓度小于1mol/L,故B错误;
C、1mol CuSO4溶于1mol水中,溶液体积不是1L,故C错误;
D、将250g CuSO4•5H2O溶于少量水后,溶质物质的量=$\frac{250g}{250g/mol}$=1mol,再稀释成1000mL,所得溶液为1mol/L的CuSO4溶液,故D正确;
故选D.
点评 本题考查了溶质浓度概念的理解应用,注意计算依据的分析判断,掌握基础是关键,题目较简单.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入少量稀NaOH溶液 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1010:1 | B. | 5×109:1 | C. | 108:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Cu2+、Na+、SO42-、Cl- | ||
| C. | Ba2+、K+、NO3-、Cl- | D. | Zn2+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
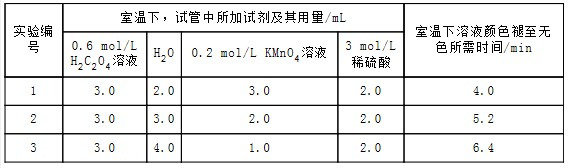
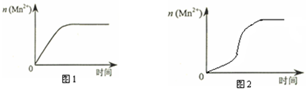
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com