
| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
分析 C4H8ClBr可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,据此分析.
解答 解:C4H8ClBr可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,
先分析碳骨架异构,分别为 C-C-C-C 与 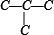 2种情况,然后分别对2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有
2种情况,然后分别对2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有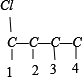 、
、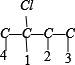 共 8 种,骨架
共 8 种,骨架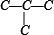 有
有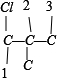 、
、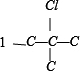 ,共 4 种,共12种,
,共 4 种,共12种,
故选D.
点评 本题考查同分异构体的书写,难度中等,注意氯原子或溴原子取代中间碳原子上的氢原子结构不同,侧重于考查学生的分析能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:多选题
| A. | “朱”的主要成分是Hg2S | B. | 该反应为置换反应 | ||
| C. | 该反应不符合质量守恒定律 | D. | 该反应Hg作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用PH试纸测定氯水的PH | |
| B. | 用硫酸镁溶液除去氢氧化镁中的氢氧化钙 | |
| C. | 用KSCN溶液检验Fe2+的存在 | |
| D. | 液溴保存时通常要加少量水液封 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
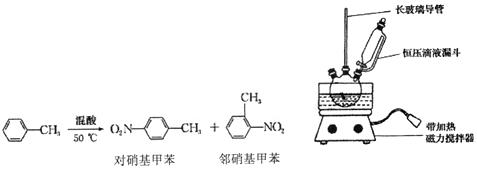
| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2Mn5O10是氧化产物 | |
| B. | 正极反应式:Ag-e-═Ag+ | |
| C. | Cl-不断向“水”电池的正极移动 | |
| D. | 毎转移2mol电子,负极质量增加71克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com