
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO﹣、Br﹣
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO ![]() 、Cl﹣
、Cl﹣
C.0.1 molL﹣1 FeCl3溶液:K+、NH![]() 、I﹣、SCN﹣
、I﹣、SCN﹣
D.由水电离的c (H+)=1×10﹣14 molL﹣1的溶液中:Ca2+、K+、Cl﹣、HCO ![]()
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】现有下列各组化合物:
A.CH3CH2CH2CHO与 ![]()
B. ![]() 与
与 ![]()
C. ![]() 与
与 ![]()
D.CH3CH2C≡CH与CH2=CH﹣CH=CH2
E. ![]() 与
与 ![]()
F.戊烯和环戊烷
①属于同系物的有 , 属于同分异构体的有 .
②根据官能团的特点可将C中两化合物分别划分为类和类.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。
I.进行如下实验:

请回答:
(1)经Ⅰ得到蓝色溶液,该过程中一定发生的化学反应是(用离子方程式表示)______。
(2)反应II的化学方程式是______________ ,X中一定含有的物质是________。
II.为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)上述过滤操作如果缺少洗涤步骤,会使得测定的固体质量均_______(填偏大、偏小或无影响)
(4)步骤Ⅳ所得蓝色溶液中阳离子为___________________(5)原混合物中SiO2的质量是___________X中一定不含有的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法正确的是( )
A. 氧化还原反应的实质是电子的转移
B. 置换反应不一定是氧化还原反应
C. 氧化剂发生氧化反应
D. 化合反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
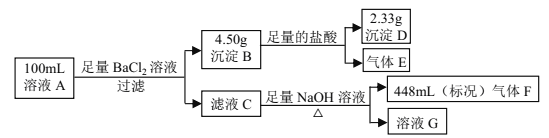
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 ![]() 2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示. 
乙酸乙酯的实验室和工业制法常采用如图2装置:回答下列问题:
(1)写出A的电子式 .
(2)B、D分子中的官能团名称分别、 .
(3)写出下列反应的反应类型:①② , ④ .
(4)写出下列反应的化学方程式:①②④
(5)制取乙酸乙酯浓H2SO4的作用是:① , ② . 欲提高乙酸的转化率,可采取的措施有、等.
(6)碳酸钠溶液的作用是 , 导气管不能插入液面以下,原因是 . 加热前,大试管中加入几粒碎瓷片的作用是 .
(7)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成.现取2.3g A与2.8L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重2.2g.回答下列问题:
(1)2.3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.“液氯”因其具有强氧化性不能用钢瓶运输
B.氧化镁具有较高的熔点,常被用于耐高温材料
C.在医疗上,纯碱可用于治疗胃酸过多,但不能用于胃穿孔病人
D.硅是一种重要的半导体材料,常被用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:

(1)试写出铁屑转化为Fe(OH)3的离子反应方程式:______________________________________。
(2)判断碘是否已完全反应的实验方法是______________________________________________。
(3)分离出NaI样品需在低温无氧环境中进行,其目的是__________________________________。
(4)测定产品中NaI含量的方法是:______________
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.1000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有______________________________。
②上述样品中NaI的质量分数为__________________________。
(5)已知Ksp(AgI)=1.5×10-16,将AgNO3和NaI的溶液混合,假设混合液中AgNO3的浓度为0.01 mol/L,则开始生成AgI沉淀时,混合液中c( I- )=____________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com