
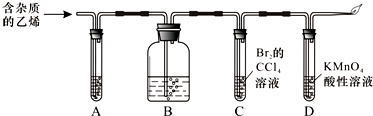
分析 乙烯中混有二氧化碳、二氧化硫,除去二氧化碳、二氧化硫,可用氢氧化钠溶液,如检验二氧化硫,应先通过品红,乙烯含有碳碳双键,可与溴的四氯化碳发生加成反应,溶液褪色,乙烯具有还原性,可与酸性高锰酸钾发生氧化还原反应,用燃烧法处理尾气,以此解答该题.
解答 解:乙烯中混有二氧化碳、二氧化硫,除去二氧化碳、二氧化硫,可用氢氧化钠溶液,如检验二氧化硫,应先通过品红,乙烯含有碳碳双键,可与溴的四氯化碳发生加成反应,溶液褪色,乙烯具有还原性,可与酸性高锰酸钾发生氧化还原反应,用燃烧法处理尾气,
(1)为了检验乙烯气体中混有SO2,可用品红溶液,然后用氢氧化钠除去二氧化硫、二氧化碳,故答案为:品红溶液;氢氧化钠溶液;
(2)乙烯含有碳碳双键,可与溴的四氯化碳发生加成反应,方程式为CH2=CH2+Br2→CH2BrCH2Br,乙烯具有还原性,可与酸性高锰酸钾发生氧化还原反应,高锰酸钾溶液褪色,乙烯在空气中燃烧,火焰明亮,并伴有黑烟.乙烯中碳的质量分数较高,燃烧时有黑烟产生,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;溶液褪色;火焰明亮,并伴有黑烟;
(3)SO2通入酸性KMnO4溶液反应生成锰离子和硫酸,反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查了乙醇的消去反应及乙烯的化学性质,题目难度不大,注意掌握乙醇的消去反应原理及乙烯的化学性质、检验方法,注意气体化学性质及检验的先后顺序.


科目:高中化学 来源: 题型:解答题
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O属同系物 | |
| B. | 35Cl与37Cl属同素异形体 | |
| C. | O2与O3属同位素 | |
| D. | 乙醇与二甲醚(CH3-O-CH3)属同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中都存在非极性键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 乙醇分子中只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
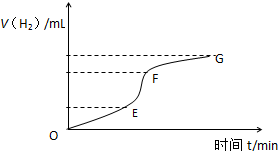 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com