
下列离子能够大量共存的是
A.无色溶液中:Fe3+、Na+、NO3-、Cl-
B.pH=0的溶液中:Fe2+、NO3-、Cl-、HCO3-
C.含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+
D.与铝作用生成氢气的溶液:Mg2+、NO3-、K+、Cl-
科目:高中化学 来源: 题型:
某研究性学习小组对铝热反应实验展开研究。查阅有关资料后得知,“铝热反应”的现象为“反应放出大量的热,并发出耀眼的白光”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点和沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | — |
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由:该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是____________,反应的离子方程式为___________________。
(3)实验室溶解该熔融物,最适宜采用下列试剂中的________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
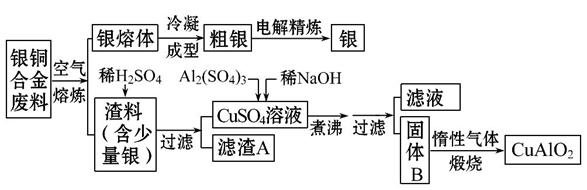
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为__________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为____________
____________________________________________________。
(2)固体混合物B的组成为____________;在生成固体B的过程中,需控制NaOH的加入量。若NaOH过量,则因过量引起的反应的离子方程式为______________
____________________________________________________。
(3)完成煅烧过程中一个反应的化学方程式:
______CuO+____Al2O3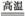 ______CuAlO2+____↑。
______CuAlO2+____↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液____________L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是__________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
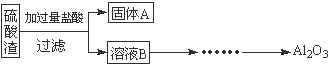
(1)写出溶液B的溶质是 。
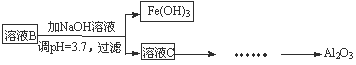
(2)参照以下框图形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) 。
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。写出反应的离方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列粒子在溶液中能大量共存的是
| 选项 | 离子或分子 |
| A | K+、NO3-、I-、H2SO3 |
| B | Na+、Fe3+、NO3-、SCN- |
| C | Al3+、NO3-、SO32-、OH- |
| D | NH4+、Na+、SO42-、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4, I2, I-等)中回收碘,其实验过程如下:
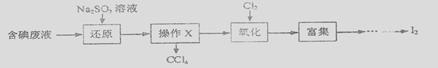
(1)操作x的名称为________________。主要的仪器是_______________________。
(2)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的 I2 还原为I-,其离子方程式为_________;该操作的目的是____________________。
(3)①在测定亚硫酸钠溶液浓度时,量取25.00mL亚硫酸钠溶液,用0.10mol·L-1的酸性高锰酸钾溶液进行滴定,下列说法正确的是_________________。
A.润洗滴定管时,应从滴定管上口加满所需的试液,使滴定管内壁充分润洗
B.高锰酸钾溶液装在酸式滴定管中,本实验无需外加指示剂
C.滴定时,眼睛注视滴定管中液面的变化
D.滴定开始时读数正确,滴定终点仰视读数,会使实验误差偏高
②达到滴定终点时,消耗高锰酸钾溶液18.00mL,则亚硫酸钠溶液的浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3—、SO42—、Na+
B.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl—、HCO3—
C.c(H+)/c(OH—)=1012的溶液中:NH4+、Al3+、NO3—、Cl—
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO—、SO42—、SCN—
查看答案和解析>>
科目:高中化学 来源: 题型:
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
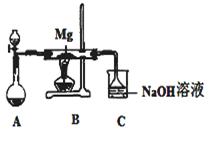
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4
③Na2SO3固体 ④CaSO3固体
(2)上述装置还可改进,改进的方法是
,
若C中NaOH为0.2mol/L、200ml,通入的SO2为1.12L(标准状况),则该反应的离子方程式为
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2 2MgSO3+S;
2MgSO3+S;
丙同学的推测是:3Mg+SO2 2MgO+MgS,
2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选。请填写下表中的空格:
根据上述实验探究:
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后的固体于试管I中 |
|
| ② | 向试管I中的固体慢慢滴加 试管I口塞上带导管的单孔塞,并将导管通入盛有 的试管II中。 | 若试管I中的 , 则丙同学推测正确。若试管I中的固体未完全溶解,且 ,则乙同学的推测正确。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com