
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色固体粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
分析 A的一种单质是自然界硬度最大的物质,应为金刚石,则A为C元素,B与C的单质在加热条件下反应生成淡黄色化合物X,X为Na2O2,D的单质既能与盐酸、也能与NaOH溶液反应生成H2,D为Al,E的单质与水蒸气反应,生成一种黑色固体Y,可知E为Fe,Y为Fe3O4,则可知C为Na,则B为O元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:(1)X为Na2O2,A为C元素,对应的稳定的氧化物为二氧化碳,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;
(2)铝与氧气反应生成氧化铝,氧化铝的熔点高,加热时,可观察到液态的D并不滴落,原因是Al熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落,
故答案为:Al熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落;
(3)钠的密度比水小,易和水反应,反应放出的热可使钠熔化,将钠加入硫酸铜溶液中,钠先和水反应生成氢气和氢氧化钠,同时生成氢氧化铜沉淀,方程式为2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑,n(Na)=$\frac{a}{23}$mol,则可生成$\frac{a}{46}$molCuO,质量为$\frac{a}{46}$mol×80g/mol=$\frac{40a}{23}$g,
故答案为:BC;2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑;$\frac{40a}{23}$g;
(4)①乙组黑色固体溶解,无气泡,说明没有铁剩余,取步骤1中溶液,滴加KSCN溶液无现象说明不含铁离子,则应为FeO,故答案为:FeO;
②甲组现象可说明黑色固体为Fe3O4,与盐酸反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
③向步骤3溶液中滴加新制氯水,因含有亚铁离子,被氧化生成铁离子,与KSCN反应,溶液变为红色,继续滴加氯水,则SCN-被过量Cl2氧化,红色褪色验证方法是向溶液中再加入KSCN溶液,溶液呈红色,则说明之前SCN-被过量Cl2氧化,
故答案为:Fe2+被氧化为Fe3+,Fe3++遇SCN-显红色;SCN-被过量Cl2氧化;向溶液中再加入KSCN溶液,溶液呈红色,则说明之前SCN-被过量Cl2氧化.
点评 本题考查无机物的推断,为高频考点和常见题型,涉及铝、铁、钠等金属的性质,注意从物质的特性以及反应的特征现象为突破口进行推断,难度不大,注意相关基础知识的积累


科目:高中化学 来源: 题型:选择题
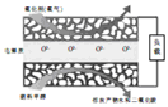 固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )
固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )| A. | 该燃料电池的负极反应式为CH3OH-6e-+3O2-═CO2↑+2H2O | |
| B. | 若有16g甲醇发生反应,该电池理论上提供的电量最多为2.895×105C | |
| C. | 氧气在负极发生还原反应 | |
| D. | O2-在电解质中的移动方向为:正极→负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,白磷比红磷稳定 | |
| C. | 相同条件下,等质量S(g)和S (s)的能量比较,S (s)能量较高 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2 (g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ②③⑥ | C. | ①②④⑦ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gFe溶于1L 0.3moL/L硝酸中,转移的电子数为0.3NA | |
| B. | 冰晶体中平均每摩尔水分子最多含有2NA个氢键 | |
| C. | 12g石墨层状结构中含有平面正六边形的数目为NA | |
| D. | 1molN2和3molH2在一定条件下充分反应形成的N-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质溶液中加入Na2SO4溶液可使其变性 | |
| B. | 氨基酸具有两性,既能与酸反应又能与碱反应 | |
| C. | 蔗糖既能发生水解反应,又能发生银镜反应 | |
| D. | 纤维素在人体内不能水解生成葡萄糖,因此对人体健康无益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3 | |
| B. | Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解 | |
| C. | Na可与冷水反应产生氢气,K也可与冷水反应生成氢气 | |
| D. | CO2可以使澄清的石灰水变浑浊,SO2也可以使澄清的石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农药波尔多液不能用铁制器皿盛放 | |
| B. | 维生素C能帮助人体将摄取的Fe3+还原为Fe2+,这说明维生素C有还原性 | |
| C. | 用硫酸可以洗去锅炉水垢 | |
| D. | 氮气常用作保护气,如填充灯泡、焊接保护等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com