
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |


科目:高中化学 来源: 题型:

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
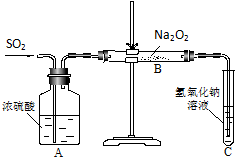 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C,木条复燃.请回答下列问题:
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C,木条复燃.请回答下列问题: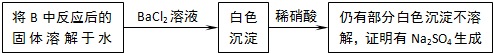
查看答案和解析>>
科目:高中化学 来源: 题型:
 常见元素及其化合物在生活生产中有着广泛的应用.
常见元素及其化合物在生活生产中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
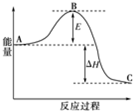 合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质结构信息 | 室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 | 单质常温、常压下是气体,能溶于水;原子的M层上只有1个未成对的p电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色火焰 | 原子最外电子层上s电子数等于p电子数;单质为空间网状晶体,具有很高的熔、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com