
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备乙炔和研究乙炔性质的实验装置图,下列有关说法错误的是( )
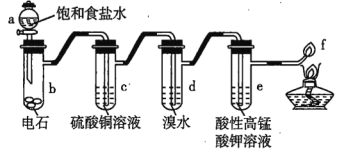
A.a中用饱和食盐水代替蒸馏水可使产生乙炔的速率更易控制
B.c中CuSO4 溶液的作用是除去影响后续实验的杂质
C.d、e中溶液褪色的原理不同,前者是氧化反应,后者是加成反应
D.f 处产生明亮、伴有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

①漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式______,____。
②某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448 mL气体,则该漂白粉中所含有效成份的质量为_____________(假设漂白粉中的其它成份不与硝酸反应)。
(2)将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:原混合物中Na2O的质量为______g,所得溶液的物质的量浓度为______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() =+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[![]() ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
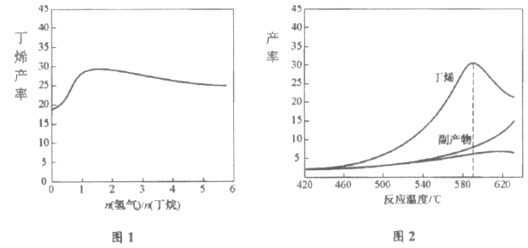
下列分析正确的是
A.随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
B.丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C.氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
D.一定温度下,控制进料比[![]() ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
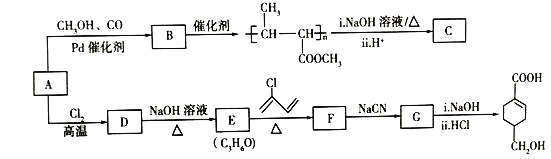
已知:①![]() +
+![]() Δ
Δ![]() ;②R-C≡N
;②R-C≡N![]() R-COOH。
R-COOH。
回答下列问题:
(1)A的名称是________
(2)C的结构简式为_______
(3)![]() 发生缩聚反应的有机产物的结构简式为________。
发生缩聚反应的有机产物的结构简式为________。
(4)E→F的化学方程式为_______.
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是________(写结构简式)。
(6)写出用苯乙烯![]() 为原料制备化合物
为原料制备化合物![]() 的合成线路,其他无机试剂任选______。
的合成线路,其他无机试剂任选______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
(1)常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-)
(2)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
(4)常温下,已知酯酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh:水的离子积为Kw:则有:Ka·Kh=Kw
(5)电解精炼铜时,电解质溶液中铜离子浓度不变
(6)如图装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③
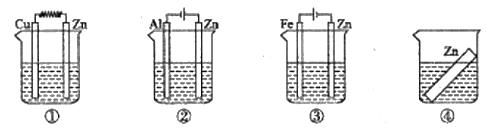
A.(1)(4)(6)
B.(1)(2)(4)(6)
C.(2)(4)(5)
D.(2)(3)(4)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com