
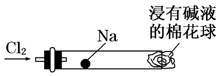
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )| A. | 反应生成的大量白烟是氯化钠晶体 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| C. | 钠着火燃烧产生苍白色火焰 | |
| D. | 发生的反应为2Na+Cl2═2NaCl |
分析 钠与氯气反应生成白色固体氯化钠,钠的焰色为黄色,灼烧发出黄色的火焰,氯气有毒,直接排放容易引起空气污染,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收氯气,据此解答.
解答 解:A.钠与氯气反应生成白色固体氯化钠,故A正确;
B.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收氯气,故B正确;
C.钠的焰色为黄色,灼烧发出黄色的火焰,故C错误;
D.钠与氯气反应生成白色固体氯化钠,方程式:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl,故D正确;
故选:C.
点评 本题考查了钠,熟悉钠的化学性质是解题关键,注意焰色反应属于元素的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有乙烯 | ||
| C. | 混合气体可能由甲烷和丙烯组成 | D. | 混合气体一定由乙烯和甲烷组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2, | B. | O2 | C. | N2 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
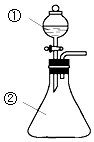 将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氨水 | 氯化铝溶液 | 产生白色沉淀 |
| B | 浓硫酸 | 铜片 | 产生大量气体溶液变蓝 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| D | 稀盐酸 | Na2CO3与NaOH的混合液 | 立即产生大量气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和硝酸银溶液反应 Cu+Ag+=Ag+Cu2+ | |
| B. | 氢氧化铝与硫酸溶液反应 OH-+H+=H2O | |
| C. | 碳酸钙与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 进入接触室的SO2和空气必须进行净化,且该反应不需要在高压下进行 | |
| D. | 催化剂V2O5能增大该反应的正反应速率而不改变逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com