
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含![]() 等)制备
等)制备![]() 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,![]() 能将
能将![]() 还原为
还原为![]()
Ⅱ. ![]() 的氧化性强于
的氧化性强于![]()
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 4.9 | 6.8 |
| 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入![]() 调节
调节![]() ,目的是__________。
,目的是__________。
(2)写出“氧化”步骤中反应的例子方程式_________。
(3)“加热”操作的目的是________。
(4)“酸化”过程中发生反应![]()
![]() 已知,“酸化”后溶液中
已知,“酸化”后溶液中![]() 则溶液中
则溶液中![]() =________。
=________。
(5)“结晶”后得到![]() 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀![]() 酸化,再由浓度为
酸化,再由浓度为![]() 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
(6)在![]() 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
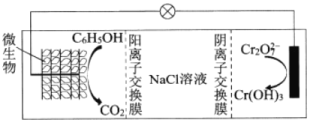
①负极的电极反应式为_________;
②处理过程中,需严格控制正极附近的pH,理由是_________
【答案】保证Cr3+沉淀完全 2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O 分解除去过量的H2O2,防止酸化过程中H2O2将Cr2O72还原 2.0×107mol/L 98% C6H5OH+11H2O-28e-=6CO2↑+28H+ 若pH过小,无法形成Cr(OH)3沉淀,若pH过大,Cr2O72会转化为CrO42,氧化性减弱,处理效果不好
【解析】
含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程:废液与足量KOH调节pH值为7~8,反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①Cr(OH)3、Fe(OH)3混合物,除去K+、SO42-等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O72-还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,以此解答。
(1)结合金属离子形成氢氧化物沉淀的pH范围,向含铬废水中加入KOH调节pH值为7~8,目的是保证Cr3+沉淀完全;
(2)结合分析,“氧化”步骤中,碱性条件下,过氧化氢氧化Cr(OH)3生成K2CrO4溶液,结合电子守恒、原子守恒有化学方程式为:2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O;
(3)因为在酸性条件下,H2O2能将Cr2O72还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O72还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,通过加热可除去;
(4)“酸化“过程中发生的反应为2CrO42+2H+Cr2O72+H2O(K=4.0×1014L3mol3),酸化”过程中pH=1,即c(H+)=0.1mol/L,c(Cr2O72)=0.16molL1,K=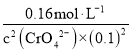 =4×1014,解得c(CrO42)=2.0×107molL1;
=4×1014,解得c(CrO42)=2.0×107molL1;
(5)结合氧化还原反应电子得失守恒规律,反应关系为:K2CrO4~6(NH4)2Fe(SO4)2,n(K2CrO4)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ×0.01mol/L×0.6L=0.001mol,则产品的纯度为
×0.01mol/L×0.6L=0.001mol,则产品的纯度为![]() ×100%=98%;
×100%=98%;
(6)①由图可知,负极发生氧化反应,C6H5OH失去电子生成CO2,根据电子守恒、电荷守恒和原子守恒,负极的电极反应式为C6H5OH+11H2O-28e-=6CO2↑+28H+;
②正极附近若pH过小,无法形成Cr(OH)3沉淀,若pH过大,Cr2O72会转化为CrO42,氧化性减弱,处理效果不好。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3·6H2O。下列实验原理和装置不能达到实验目的的是
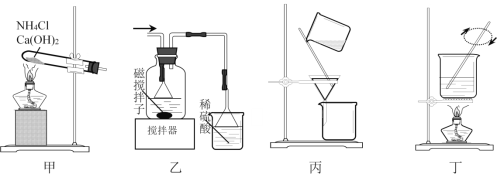
A. 用装置甲制备NH3
B. 用装置乙制备Cu(NH3)4Cl2并沉铁
C. 用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3
D. 用装置丁将FeCl3溶液蒸干制备FeCl3·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)只用试管和胶头滴管就可以对下列各组中的溶液进行鉴别的是_______(填序号)。
①AlCl3 溶液和 NaOH 溶液②Ca(HCO3)2 溶液和 NaOH 溶液
③NaAlO2 溶液和盐酸④Al2(SO4)3 溶液和氨水
⑤苯与水⑥AgNO3、BaCl2、K2SO4 和 Mg(NO3)2 四种溶液
⑦NaNO3、FeCl3、NaCl、AgNO3四种溶液⑧NaHCO3 溶液与稀硫酸
(2)按以下实验方案可从海洋物质样品中提取具有抗肿瘤活性的天然产物。
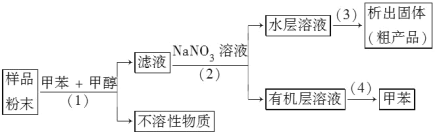
则(1)(2)(3)(4)的分离提纯方法依次为__________、__________、__________、__________。
(3)下列说法正确的是_________(填序号)。
①常压蒸馏时,加入液体的体积可超过圆底烧瓶容积的三分之二
②除去铜粉中混有 CuO 的实验操作是加入稀硝酸溶解、过滤、洗涤、干燥
③将 Cl2 与 HCl 的混合气体通过饱和食盐水可得到纯净的Cl2
④用 CCl4 萃取碘水中的 I2 的实验操作是先从分液漏斗下口放出有机层,后从上口倒出水层
⑤滤液若浑浊,可能是液面高于滤纸边缘造成的
⑥NaCl 溶液蒸发时可以加热至蒸干为止
⑦蒸馏时,可以把温度计插入混合液体中
⑧可以用酒精萃取碘水中的I2。
⑨CCl4 萃取溴水中溴时,静置分层后上层为橙红色,分液时,从上口先倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A. 蚕丝属于天然高分子材料
B. 蚕丝的主要成分是蛋白质
C. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
D. “蜡炬成灰”过程中发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O=MnOOH+OH-,下列说法正确的是

A.铝电极上的电极反应式:Al-3e-=Al3+
B.电池工作时,NH4+移向石墨电极
C.每消耗2.7g铝就会有0.3mol电子通过溶液转移到正极上
D.放电过程中正极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某有机物分子式为C4H10O,并能与钠反应放出氢气(不含立体异构),其同分异构体数目为5
B.乙烯和苯均能使溴水褪色,且原理相同
C.用水可鉴别乙醇和乙酸乙酯
D.与Na反应的剧烈程度:CH3COOH>CH3CH2OH>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
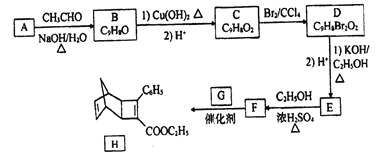
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1) E的结构简式为_______。
(2) E生成F的反应类型为_______。
(3) 1mol化合物H最多可与_______molH2发生加成反应。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______。
(5)芳香化合物X是F同分异构体,X能与饱和碳酸氢钠反应放出CO2,其核磁共振氢谱显示有4种不同化学环境氢,峰面积比之为6:2:1:1,写出1种符合要求的X的结构简式_____。
(6)写出用环戊烷和2-丁炔为原料制备化合物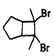 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com