
【题目】氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气。根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:

操作步骤及有关现象如下:
①装好装置,检查装置的气密性,加入药品。
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)用化学方程式表示实验室制取Cl2的反应:____________________________________;若以含14.6g HCl的浓盐酸与足量MnO2充分反应,制得的Cl2在标准状况下总小于2.24L,原因可能是____________________________________________________。
(2)装置B中为湿润的KI-淀粉试纸,反应一段时间后试纸变蓝,能否仅通过该现象说明A装置中产生氯气?___________(填“能”或“不能”),请用离子方程式说明原因________;装置C中湿润的红色布条褪色,是因为产生了具有强氧化性的物质:_____。
(3)实验证明,Na2O2可以与HCl反应生成氯气,请写出反应的化学方程式:_____________。
(4)装置D的作用之一是吸收生成的氯气,请写出相应的离子方程式:_________________。
(5)利用Na2O2与浓盐酸反应制得的Cl2中通常含有的杂质气体有:___________(不包括水蒸气),较难分离,因此实验室很少用该方法制取氯气。
【答案】 MnO2 + 4HCl(浓) ![]() MnCl2+ 2H2O + Cl2 ↑ 随着反应的进行,盐酸浓度变小,MnO2与稀盐酸不反应,该反应停止;加热过快,部分HCl挥发 不能 4H++ 4I-+ O2 = 2H2O + 2I2 HClO Na2O2 + 4HCl = 2NaCl + 2H2O + Cl2↑ Cl2 + 2OH- = Cl- + ClO- + H2O O2 、HCl
MnCl2+ 2H2O + Cl2 ↑ 随着反应的进行,盐酸浓度变小,MnO2与稀盐酸不反应,该反应停止;加热过快,部分HCl挥发 不能 4H++ 4I-+ O2 = 2H2O + 2I2 HClO Na2O2 + 4HCl = 2NaCl + 2H2O + Cl2↑ Cl2 + 2OH- = Cl- + ClO- + H2O O2 、HCl
【解析】(1)实验室利用二氧化锰氧化浓盐酸制备氯气,反应的化学方程式为MnO2 + 4HCl(浓)![]() MnCl2+ 2H2O + Cl2↑;由于加热过快,部分HCl挥发,反应中还有水生成,随着反应的进行,盐酸浓度变小,MnO2与稀盐酸不反应,该反应停止,因此制得的Cl2在标准状况下总小于2.24L;(2)O2具有强氧化性,能将碘离子氧化为I2:4H++ 4I-+ O2 = 2H2O + 2I2,故湿润的碘化钾-淀粉试纸变蓝不能说明有氯气生成;装置C中湿润的红色布条褪色,说明有次氯酸生成,氯气和水反应生成次氯酸和盐酸,故A中生成了氯气;(3)Na2O2可以与HCl反应生成氯气,氧元素化合价降低,生成物中还有水生成,根据元素守恒还有NaCl生成,反应的化学方程式为Na2O2 + 4HCl = 2NaCl + 2H2O +Cl2↑。(4)装置D的作用之一是吸收生成的氯气,氯气与氢氧化钠溶液反应的离子方程式为Cl2 + 2OH- = Cl- + ClO- + H2O。(5)过氧化钠和水反应生成氧气,浓盐酸易挥发,所以通常含有的杂质气体有氧气和氯化氢气体。
MnCl2+ 2H2O + Cl2↑;由于加热过快,部分HCl挥发,反应中还有水生成,随着反应的进行,盐酸浓度变小,MnO2与稀盐酸不反应,该反应停止,因此制得的Cl2在标准状况下总小于2.24L;(2)O2具有强氧化性,能将碘离子氧化为I2:4H++ 4I-+ O2 = 2H2O + 2I2,故湿润的碘化钾-淀粉试纸变蓝不能说明有氯气生成;装置C中湿润的红色布条褪色,说明有次氯酸生成,氯气和水反应生成次氯酸和盐酸,故A中生成了氯气;(3)Na2O2可以与HCl反应生成氯气,氧元素化合价降低,生成物中还有水生成,根据元素守恒还有NaCl生成,反应的化学方程式为Na2O2 + 4HCl = 2NaCl + 2H2O +Cl2↑。(4)装置D的作用之一是吸收生成的氯气,氯气与氢氧化钠溶液反应的离子方程式为Cl2 + 2OH- = Cl- + ClO- + H2O。(5)过氧化钠和水反应生成氧气,浓盐酸易挥发,所以通常含有的杂质气体有氧气和氯化氢气体。


科目:高中化学 来源: 题型:
【题目】向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应后,则参加反应的NaOH的物质的量为________;原NaOH溶液的物质的量浓度为________;生成标准状况下H2的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法规范的是( )
A. 98g稀硫酸所含分子数为1mol B. 氧的摩尔质量为32g/mol
C. 某硫酸溶液中H2SO4的质量分数为60% D. 标准状况下,1mol气体的体积约为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成: 2H2(g)+CO(g)CH3OH(g)△H=﹣90.0kJmol﹣1①
2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣24.5kJmol﹣1②
CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.1kJmol﹣1③
(1)下列说法正确的是
A.反应①的△S<0、△H<0,所以能在较低温度下自发进行.
B.反应③的H2O与CO的生成速率之比为1:1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式 .
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)B点的v(正)(填“>”、“<”或“=”),说明理由 . 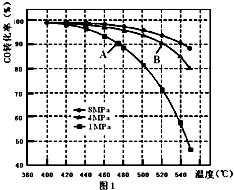
(4)一定温度下,密闭容器中发生反应③,该反应的平衡常数表达式k=;水蒸气的转化率与 ![]() 的关系如图2,计算该温度下反应③的平衡常数K= .
的关系如图2,计算该温度下反应③的平衡常数K= . 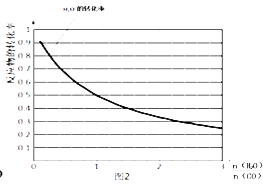
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫酸反应,转移电子数目为0.2NA
D.常温下,1 L 1 molL﹣1的CH3COOH溶液中,所含溶质分子数小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图1所示: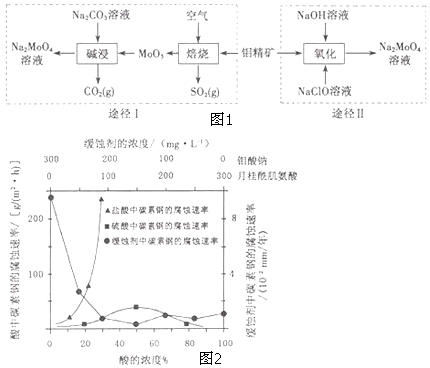
(1)NaClO的电子式是 .
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 .
(3)途径I碱浸时发生反应的离子方程式为 .
(4)途径Ⅱ氧化时发生反应的离子方程式为 .
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 .
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 .
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(1)在光照条件下,氯气和氢气反应过程如下: ①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
(2)已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.
(3)卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是(填字母).
A.卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高
B.原子半径按
C.Cl、Br、I的顺序由大到小
D.卤化氢的稳定性按的H
E.HCl、HBr、HI的顺序由强到弱
F.卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易
(4)碘单质及其化合物具有重要应用.下列说法正确的是(填字母). a. ![]() I与
I与 ![]() I互为同位素
I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方祛可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)制取所需的FeSO4溶液需要的反应物为_______。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________。
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(3)在试管Ⅰ里加入的试剂是________________________________________。
(4)在试管Ⅱ里加入的试剂是________________________________________。
操作:先打开止水夹,使I管中反应一段时间后再夹紧止水夹,实验中观察到I管中溶液被压入II管中,II中发生反应的离子方程式为:_____________。
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com