
【题目】(1)工业上氨气的催化氧化反应的化学方程式_____________
(2)偏铝酸钠溶液中通入过量二氧化碳的离子方程式_____________;
(3)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g) = CF4(g)+4HF(g)
ΔH =-1940 kJ·mol-1,计算H—F键的键能为______________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | ? | 155 |
(4)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和一种还原性的气体,放出热量4.28kJ,写出该反应的热化学方程式_________________。
【答案】4NH3+5O2![]() NO+6H2O, AlO2-+CO2+2H2O=Al(OH)3↓ +HCO3- 565 kJ·mol-1 2Cl2 (g)+2C(s)+TiO2(s)=TiCl4(l)+2CO(g) ΔH =-85.6 kJ·mol-1
NO+6H2O, AlO2-+CO2+2H2O=Al(OH)3↓ +HCO3- 565 kJ·mol-1 2Cl2 (g)+2C(s)+TiO2(s)=TiCl4(l)+2CO(g) ΔH =-85.6 kJ·mol-1
【解析】
(1)工业上利用氨气与氧气催化氧化可生成NO和H2O;
(2)偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝与碳酸氢钠;
(3)依据化学反应的焓变=反应物总键能-生成物总键能,计算得到反应的焓变;
(4)先根据质量守恒定律书写其化学方程式,再结合反应热与热化学方程式之间的关系正确书写热化学方程式。
(1)工业上利用氨气与氧气催化氧化可生成NO和H2O,其化学方程式为:4NH3+5O2![]() NO+6H2O,,
NO+6H2O,,
故答案为:4NH3+5O2![]() NO+6H2O,;
NO+6H2O,;
(2)偏铝酸钠溶液中通入过量二氧化碳的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓ +HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓ +HCO3-;
(3)化学反应的焓变=反应物总键能-生成物总键能,设H—F键的键能为x,则CH4(g)+4F2(g) = CF4(g)+4HF(g) ΔH =-1940 kJ·mol-1=(414 kJ/mol×4+155 kJ/mol×4)-(489kJ/mol×4+x×4),解得x=565 kJ·mol-1,
故答案为:565 kJ·mol-1;
(4)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28 kJ,由质量守恒可知还原性气体为CO,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)=TiCl4(l)+2CO(g),则2 mol氯气反应放出的热量为20.1×4.28kJ=85.6kJ,所以热化学方程式为2Cl2(g)+TiO2(s)+2C(s)=TiCl4(l)+2CO(g) △H=-85.6kJmol-1。
故答案为:2Cl2 (g)+2C(s)+TiO2(s)=TiCl4(l)+2CO(g) ΔH =-85.6 kJ·mol-1


科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A. 氢氧化镁中滴加盐酸:H++OH-=H2O
B. 用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+
C. 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D. NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH-![]() NH3+CO32-+2H2O
NH3+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
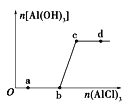
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:K+、Ag+、Ca2+、NO3-
D. d点对应的溶液中:K+、NH4+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li—CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域。
(1)Li—CuO电池中,金属锂做_______极 。
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量的大小:____________。
(3)通过如下过程制备CuO。
![]()
①过程Ⅰ,H2O2的作用是__________________。
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是_____________________。
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。

二者比值为1:0.8时,产品中可能含有的杂质是_____________,产生该杂质的原因是_________________________________。
④ 过程Ⅲ反应的化学方程式是_________________________。
(4)Li—CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如下。放电时,正极的电极反应式是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物已略)。下列说法不正确的是
![]()
A. X、Y、Z中至少有一种相同的元素,该元素可以是金属元素也可以是非金属元素
B. 物质W可能是化合物,也可能是单质
C. 上述转化关系中不可能出现置换反应
D. 若X、Y、Z中均含有一种常见金属元素,则W可能是强酸也可能是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油、煤、天然气都属于化石燃料
B.油脂在碱性条件下的水解反应又称为皂化反应
C.分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体
D.麦芽糖是还原性糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(加热装置已略去)或操作合理的是( )
|
|
|
|
A.吸收氨气并防倒吸 | B.用SO2与Ba(NO3)2反应获得BaSO3沉淀 | C.分离溴苯和苯的混合物 | D. 验证HCl的溶解性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜。下列叙述正确的是

A. a 为电源的正极
B. 工作时,OH向左室迁移
C. 右室电极反应为:C2H5OH+H2O4e=CH3COO+5H+
D. 生成 H2 和 CH3COONa 的物质的量之比为 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
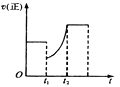
A. t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B. t1时降低了温度,平衡向正反应方向移动
C. t1时减小了压强,平衡向逆反应方向移动
D. t1时减小了SO2的浓度,又增加了SO3的浓度,导致平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com