
分析 ①碳酸氢钠与硫酸氢钠反应生成硫酸钠、二氧化碳气体和水,所以反应中有气泡产生;
②氯化铁溶液与氢氧化钠反应生成红褐色的氢氧化铁沉淀.
解答 解:①向NaHCO3溶液中加入NaHSO4溶液,二者反应生成硫酸钠、二氧化碳和水,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,所以会有气泡产生,
故答案为:有气泡产生;HCO3-+H+=CO2↑+H2O;
②向FeCl3溶液中加入NaOH溶液,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,所以会产生红褐色沉淀,
故答案为:产生红褐色沉淀;Fe3++3OH-=Fe(OH)3↓.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则.


科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,2.24L乙醇中碳氢键的数目为0.5NA | |
| B. | 1L0.1mol•L-1硫酸钠溶液中含有的氧原子数为0.4NA | |
| C. | 0.1molKI与0.1molFeCl3在溶液中反应转移的电子数为0.1NA | |
| D. | 0.1mol乙稀与乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
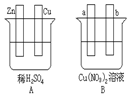 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Zn,Zn+NaHSO4 | B. | Cu(OH)2+H2SO4,Cu(OH)2+HNO3 | ||
| C. | CaO+HCl,CaO+HNO3 | D. | BaCl2+NaHSO4,Ba(OH)2+NaHSO4(少量) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的大小 | B. | 能否透过滤纸或半透膜 | ||
| C. | 是否为大量分子或离子的集合法 | D. | 能否产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀硝酸的氧化性强于浓硝酸 | |
| D. | 用10 mL量筒量取9.2 mL NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的分子式:CH3COOH | B. | 甲烷的结构简式:CH4 | ||
| C. | 35Cl表示该氯原子核内有20个中子 | D. | SiO2是二氧化硅的分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
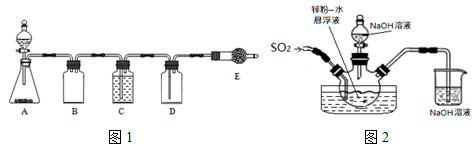
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com