
| 操作及现象 | ||
| A | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 将砂纸打磨过的铝箔置于酒精灯外焰上灼烧,熔化的铝以小液滴的形式滴落下来 | Al的熔点低,加热时Al熔化 |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无Κ+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CO32-和HCO3-都能和稀盐酸反应生成CO2;
B.铝在酒精灯上加热到熔化,生成熔点高的氧化铝,熔融但不滴落;
C.K元素焰色反应必须透过蓝色钴玻璃观察;
D.亚铁离子和KSCN溶液不反应,铁离子和KSCN溶液反应生成络合物而使溶液呈血红色.
解答 解:A.CO32-和HCO3-都能和稀盐酸反应生成CO2,某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体,溶液中可能含有CO32-或HCO3-或二者都有,故A错误;
B.铝在酒精灯上加热到熔化,因为表面有高熔点的氧化铝包着,所以不滴落,故B错误;
C.K元素焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,故C错误;
D.亚铁离子和KSCN溶液不反应,铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,向某溶液中先加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红,则说明原溶液中含有亚铁离子不含铁离子,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、铝的性质、焰色反应等知识点,明确实验原理及物质性质是解本题关键,注意从实验现象、物质性质及基本操作方法来分析评价,易错选项是A,注意排除其它离子的干扰,题目难度不大.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| B. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| C. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向氯化铝溶液中加入足量氨水:A13++4NH3•H2O═AlO2-+2H2O+4NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
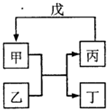 甲乙丙丁戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足右图转化关系的是( )
甲乙丙丁戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足右图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| A | NH3 | Cl2 | N2 | H2 |
| B | C | SiO2 | CO | CuO |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
| D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol/L的盐酸,产生CO2的体积与所加稀盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol/L的盐酸,产生CO2的体积与所加稀盐酸体积之间关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com