
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化剂在反应中被氧化,还原剂在反应中被还原 |
分析 氧化还原反应的本质是有电子的转移,表现为氧化还原反应中一定有元素化合价的变化,在氧化还原反应中得电子的反应物作氧化剂,被还原,失电子的反应物作还原剂,被氧化.
解答 解:A.氧化还原反应的实质是电子的转移(得失或偏移),特征为有元素化合价的变化,故A正确;
B.氧化还原反应可发生在同一种元素之间,如反应2H2S+SO2═3S↓+2H2O中只有硫元素的化合价变化,故B错误;
C.失电子的反应物作还原剂,被氧化,得电子的反应物作氧化剂,被还原,故C错误;
D.还原剂,被氧化,氧化剂,被还原,故D错误.
故选A.
点评 本题考查氧化还原反应及常见的化学反应,为高频考点,侧重于学生的分析能力的考查,要求学生熟悉利用元素的化合价来分析性质,并能利用具体的化学反应来说明问题即可解答,难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
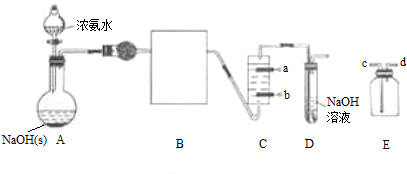
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
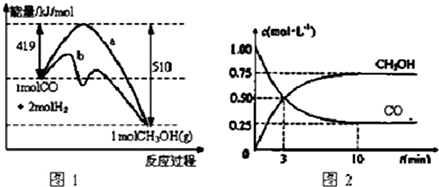
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.8mol•L-1•s-1 | D. | v( D )=1.0mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度0C化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①② | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、O3 | B. | H2SO4、H2CO3 | C. | SO2、NO | D. | Na2SO3、KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com