
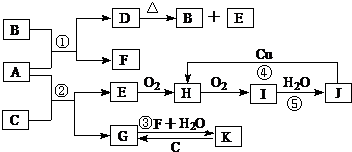
 ,
, .
.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
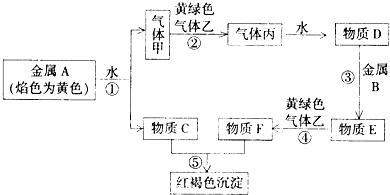
查看答案和解析>>
科目:高中化学 来源: 题型:
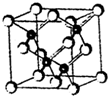 发光二极管(LED)晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
发光二极管(LED)晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 化学能在一定的条件下可以转化为电能.
化学能在一定的条件下可以转化为电能.查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
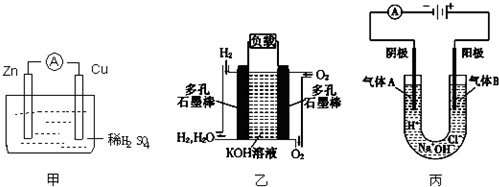
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol.L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、0.1mol.L-1 NaOH溶液:Na+、Ca2+、I-、NH4+ |
| C、中性溶液:Fe3+、Al3+、NO3-、SO42- |
| D、c(H+)水电离=10-12 mol?L-1的溶液:Ba2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-、Na+、HCO3-、Cl- |
| B、Ba2+、Na+、Cl-、SO42- |
| C、K+、Al3+、SO42-、OH- |
| D、Ag+、Al3+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用HNO3溶液完全中和后,溶液不显中性 |
| B、加水稀释后,溶液中c(NH4+)?c(OH-)变大 |
| C、与AlCl3溶液发生反应的离子方程式为 Al3++3OH-=Al(OH)3↓ |
| D、其溶液的pH=13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com