
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
分析 C(H+)•C(OH-)=Kw,纯水溶液中氢离子浓度始终等于氢氧根离子浓度,温度不变,水的离子积常数不变.
在25℃时,纯水的电离度为α1,水电离出的c(H+)=c(OH-)=1×10-7mol•L-1;
pH=11的氨水溶液中C(H+)=10-11mol/L,水电离出的C(H+)=C(OH-)=10-11mol/L,水的电离度为α2;
pH=3的盐酸中C(H+)=10-3mol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,求得水电离出的C(H+)=C(OH-)=10-11mol/L,水的电离度为α3;
pH=3的盐酸和pH=11的氨水等体积混合,NH3•H2O+HCl═NH4Cl+H2O,酸碱中和反应放热,促进水的电离,生成的盐为强酸弱碱盐,水解促进水的电离,所得溶液中水的电离度为α4,据此分析解答.
解答 解:在25℃时,纯水中H2O?H++OH-,Kw=C(H+)•C(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7mol•L-1,纯水的电离度为α1;酸碱抑制水的电离,水解的盐促进水的电离;
pH=11的氨水溶液中C(H+)=10-11mol/L,溶液中C(H+)来自于水的电离,水电离出的C(H+)=C(OH-)=10-11mol/L,pH=11的氨水溶液中水的电离度为α2,α2<α1;
pH=3的盐酸中C(H+)=10-3mol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,所以溶液中C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,溶液中C(OH-)来自于水的电离,水电离出的C(H+)=C(OH-)=10-11mol/L,pH=3的盐酸中水的电离度为α3,α3=α2<α1;
盐酸为强电解质,pH=3的盐酸和pH=11的氨水按等体积混合,反应后氨水过量,NH3•H2O+HCl═NH4Cl+H2O,酸碱中和反应放热,由于水的电离是吸热过程,温度升高,促进水的电离,平衡向着正向移动,生成的盐为强酸弱碱盐,水解促进水的电离,混合溶液中为氯化铵和一水合氨,电离大于水解,溶液呈碱性,所以反应后所得溶液中水的电离度为α1>α4;
故选C.
点评 本题主要考查了水的电离平衡的影响因素,注意Kw,温度升高可以促进水电离Kw增大,本题难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:选择题
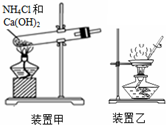
| A. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用装置甲制备氨气 | |
| D. | 用装置乙加热分解Al(OH)3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-131:${\;}_{53}^{77}$I | B. | Cl-的结构示意图: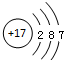 | ||
| C. | 乙炔的结构简式:CHCH | D. | Na2S的电子式: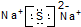 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.4×10-7 |
| Ki2=4.7×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO-<HCO3-<F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
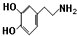 .
.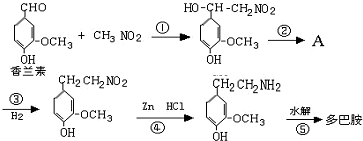
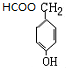
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 按系统命名法 的名称为:4,7-二甲基-3-乙基壬烷 的名称为:4,7-二甲基-3-乙基壬烷 | |
| B. | 等物质的量的Na、NaOH、NaHCO3分别与足量的有机物( )充分反应,消耗该有机物的物质的量之比为2:3:6(已知酸性大小关系 )充分反应,消耗该有机物的物质的量之比为2:3:6(已知酸性大小关系 >H2CO3> >H2CO3> ) ) | |
| C. | 乙醇和二甲醚互为同分异构体,CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| D. | 蛋白质、油脂、糖均能在一定条件下水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com