
下列说法不正确的是
A.氢能将是二十一世纪的重要能源,推广应用氢能最关键技术是高容量储氢材料的研制
B.纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,由此可推测TiO2光触媒技术制成的“木地板精油可以有效降解甲醛、苯、氨等居室污染物
C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路”
D.门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)  2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。
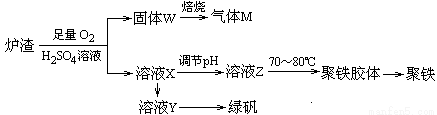
A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:实验题
乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:
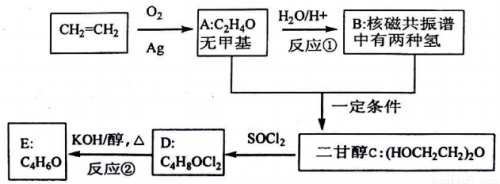
(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
下列有关胶体的说法错误的是:
A.胶粒可以透过滤纸,不能透过半透膜
B.采用喷雾型药剂形成一定大小的液珠,可有效提高药物疗效
C.冶金工业的矿粒除尘利用了丁达尔效应
D.空气中的雾霾现象体现了胶体的存在
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mol/L,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 mol•L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1mol/LNa2CO3中c(HCO3﹣)比0.1mol/LH2CO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:填空题
氮、硫的化合物与人类生活和生产有着密切的联系。请回答下列问题:
(1)在空气质量报告的各项指标中,有SO2和NO2的指数,SO2是一种无色有毒气体,NO2是一种 (填“无色”或“红棕色”)有毒气体;
(2)氨气极易溶于水,其水溶液显 (填“酸”、“碱”或“中”)性;
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出 (填“吸水”、“脱水”或“氧化”)性。
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出 (填“吸水”、“脱水”或“氧化”)性。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
右图为某化学兴趣小组设计的一个原电池,装置中电流表的指针发生偏转,则X应为
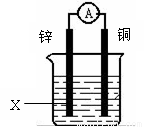
A.水 B.酒精
C.稀硫酸 D.植物油
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:填空题
1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。
①则该溶液中一定不含有的离子是 ;
②可能存在的阳离子有 ;
③肯定不存在的阴离子是 。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向2 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题。
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①a的值为 ;
②当通入Cl2的体积为3.36 L(标准状态下)时,溶液中发生反应的离子方程式为 ;此时溶液中Br-、I-的物质的量浓度分别为c(Br-)= ,c(I-)= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列关于卤族元素的说法正确的是
A.F、Cl、Br、I最高正化合价都为+7
B.卤族元素的单质只有氧化性
C.从F到I,原子的得电子能力依次减弱
D.卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com