
 =0.2mol,过氧化钠完全反应,反应中过氧化钠起氧化剂、还原剂作用,各占
=0.2mol,过氧化钠完全反应,反应中过氧化钠起氧化剂、还原剂作用,各占 ,
, ×2=0.2mol,
×2=0.2mol, =0.2mol,令生成的氢氧化钠的物质的量为xmol,氧气为ymol,则:
=0.2mol,令生成的氢氧化钠的物质的量为xmol,氧气为ymol,则: .所以生成气体为:
.所以生成气体为: mol
mol  ×
× mol
mol  mol 3×
mol 3× mol
mol ×
× mol+3×
mol+3× mol)×22.4L/mol=
mol)×22.4L/mol= L,
L, =
= mol,生成气体为:
mol,生成气体为: mol
mol  ×
× mol
mol ×
× mol×22.4L/mol=
mol×22.4L/mol=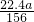 L.
L.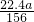 <V<
<V< .
.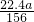 <V<
<V< .
. ,据此计算;
,据此计算;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 22.4a |
| 156 |
| 156.8a |
| 264 |
| 22.4a |
| 156 |
| 156.8a |
| 264 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将15.6gNa2O2与2.7gAl粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为 ,
该反应中的转移电子的物质的量为 mol。
(2)反应结束时生成气体的体积在标准状况下为 L。
(3)取agNa2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是 ,(用含a的代数式表示,结果可不化简)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省泰安市新泰市高三(上)月考化学试卷(10月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com