
| A. | 纯水100℃和25℃的pH值 | |
| B. | 氢硫酸溶液中的H+和HS-的浓度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 25℃,pH=11的KOH溶液与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
分析 A.水的电离是吸热反应,升高温度促进水电离,根据溶液中氢离子浓度大小判断;
B.氢硫酸分两步电离,H2S?H++HS-,HS-?H++S2-,据此分析两种离子浓度大小;
C.相同温度相同溶质的弱电解质溶液中,溶液越稀,电解质的电离程度越大;
D.根据水的电离程度分析,酸或碱抑制水电离,酸中氢离子、碱溶液中氢氧根离子浓度越大,抑制程度越大.
解答 解:A.水的电离是吸热反应,温度越高,水的电离程度越大,则其pH越小,故A错误;
B.氢硫酸分两步电离,H2S?H++HS-,HS-?H++S2-,氢硫酸溶液中的H+和HS-的浓度,前者比后者大,故B正确;
C.相同温度相同溶质的弱电解质溶液中,溶液越稀,电解质的电离程度越大,所以0.1mol/L的CH3COOH大于1mol/L的CH3COOH的电离程度,且二者的物质的量相等,所以100mL0.1mol/L的CH3COOH溶液大于10mL 1mol/L的CH3COOH溶液的H+数目,故C正确;
D.同温下pH=11的KOH溶液中氢氧根离子浓度为0.001mol/L,氢氧化钾溶液中的氢离子是水电离的,水电离的氢氧根离子为:1×10-11mol/L,
pH=3的CH3COOH溶液中氢离子浓度为0.001mol/L,醋酸中氢氧根离子是水电离的,则水电离的氢氧根离子浓度为1×10-11mol/L,所以两溶液中水电离的氢氧根离子浓度相等,故D错误;
故选BC.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确盐的水解原理、弱电解质的电离平衡的影响因素为解答关键,试题培养了学生的分析、理解能力灵活应用能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| 加3%Na2S2O3/mL | 加1:5的H2SO4/滴 | 温度/℃ | |
| A | 5 | 25 | 25 |
| B | 5 | 15 | 35 |
| C | 5 | 25 | 45 |
| D | 5 | 15 | 45 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaCl固体置于托盘天平右盘称量:左盘砝码(8g)和游码(0.6g)读数的和为8.6g | |
| B. | 容量瓶上标有刻度线、温度和浓度,使用前要事先检查是否漏水 | |
| C. | 配制一定物质的量浓度的溶液用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管 | |
| D. | 配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,则配出浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S2-、K+、NO3-、SO42- | B. | H+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、K+、S2O32-、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
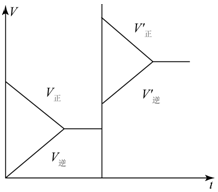 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | X、Y中之一为气体,Z、W为非气体 | ||
| C. | X、Y、Z、W皆为气体 | D. | X、Y为气体,Z、W中之一为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中的能量变化除了热能外,还可以是光能、电能等 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铜粉中 | 溶液变蓝,试管口观察到了红棕色气体 | 铜将稀硝酸还原成二氧化氮 |
| B | 将SO2通入过量的饱和NaHCO3溶液中 | 有无色无味气体产生 | 非金属性:S大于C |
| C | 乙醇和浓硫酸混合加热,将产生的气体通入酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 证明乙醇发生了消去反应产生烯烃 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1 CuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com